Estrutura prometida (PM), propriedades, obtenção, usos

- 3523
- 546
- Terrence King IV
Ele prometido É um elemento químico que pertence à aula de Lantanids. É identificado com o símbolo PM e seu número atômico é 61. É um sólido metálico radioativo e é o elemento mais instável dos primeiros 84 elementos da tabela periódica.
Este elemento é encontrado naturalmente em concentrações muito baixas (cerca de 4 x 10-quinze gramas por kg) em um tipo de uraninita, que é um mineral de urânio, no qual o prometido está presente devido à fissão espontânea do urânio-238.
 Símbolo, número atômico e massa atômica da promessa. Fonte: ME/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/2.5). Fonte: Wikimedia Commons.
Símbolo, número atômico e massa atômica da promessa. Fonte: ME/CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/2.5). Fonte: Wikimedia Commons. A pesar de su escasez en la corteza terrestre, ha sido detectado en el espectro de la estrella HR465 de la constelación Andrómeda, sobre cuya superficie se estima que se ha estado formando recientemente, pues ningún isótopo de Pm tiene una vida media más larga de 17 ,7 anos.
Foi útil em objetos que brilham no escuro, mas devido à sua radioatividade que parou de usar nesses. É usado para medir a espessura do material e as baterias de energia nuclear.
[TOC]
Descoberta
A existência do prometio foi suspeita em 1902 pelo químico tcheco Bohuslav Brauner. Mais tarde, em 1914, o físico inglês Henry Moseley descobriu em seus estudos que faltava um elemento entre o neodímio e o samário.
Posteriormente, embora vários grupos de pesquisadores (italianos em 1924, os americanos em 1926 e 1938) anunciaram sua descoberta, a dificuldade de separá -lo de outros elementos e reproduzir as experiências que não foram capazes de tomar mérito.
 Jacob a. Marinsky. Domínio ornl / pub. Fonte: Wikimedia Commons.
Jacob a. Marinsky. Domínio ornl / pub. Fonte: Wikimedia Commons. Finalmente, em 1944, os pesquisadores Marinsky J.PARA., Glendenin l.E. e Coryell c.D. Eles testaram sua presença e o isolaram dos produtores de fissão de urânio no reator nuclear dos laboratórios de Clinton em Oak Ridge, no Tennessee, Estados Unidos.
 Larry e. Glendenin. Domínio ornl / pub. Fonte: Wikimedia Commons.
Larry e. Glendenin. Domínio ornl / pub. Fonte: Wikimedia Commons. No entanto, eles não reivindicaram a prioridade na descoberta até 1946 por serem dedicados totalmente a investigações secretas relacionadas às atividades de defesa durante a Segunda Guerra Mundial.
Atribuição de nome
Embora os pesquisadores tivessem proposto chamá -lo de "clintonia" em homenagem aos laboratórios onde trabalhavam, a esposa de Coryell os convenceu a chamá -lo de "prometido" como uma lembrança do titã grego Prometheus ou Prometheus.
 Charles d. Coryell. Autor da foto: cristão a. Coryell/GFDL (http: // www.gnu.Org/copyleft/fdl.html). Fonte: Wikimedia Commons.
Charles d. Coryell. Autor da foto: cristão a. Coryell/GFDL (http: // www.gnu.Org/copyleft/fdl.html). Fonte: Wikimedia Commons. De acordo com algumas interpretações da mitologia grega, Prometheus roubou o fogo dos deuses para entregá -la à humanidade, então ele foi cruelmente punido por toda a eternidade. Outras lendas dizem que isso forneceu aos seres humanos matemática, ciência, agricultura e medicina, e até criou o homem.
Pode atendê-lo: Clausius clapeyron Equação: Para que é, exemplos, exercícios Representação de Prometeu por um escultor alemão. © El Grafo / CC-BY-SA-4.0 / domínio pub. Fonte: Wikimedia Commons.
Representação de Prometeu por um escultor alemão. © El Grafo / CC-BY-SA-4.0 / domínio pub. Fonte: Wikimedia Commons. Essas dúvidas sobre o que foi a contribuição de Prometeu para a humanidade se assemelha à incerteza sobre quem descobriu o elemento. Por outro lado, de acordo com a esposa de Coryell, o nome foi justificado como os pesquisadores "roubaram o fogo dos deuses" ao descobrir -o durante o programa Secreto da Bomba Atômica.
Estrutura eletrônica
A configuração eletrônica deste elemento é:
1s2; 2s2 2p6; 3s2 3p6 3d10; 4s2 4p6 4d10; 5s2 5p6; 4F5 6s2;
que também pode ser expresso como:
[XE] 4F5 6s2.
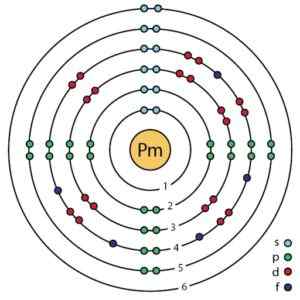 Estrutura eletrônica prometio de acordo com o modelo atômico aprimorado de Bohr. Ahazard.ScienceWriter/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Estrutura eletrônica prometio de acordo com o modelo atômico aprimorado de Bohr. Ahazard.ScienceWriter/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Nomenclatura
- Prometido, símbolo PM.
- Prometio-147, PM-147 ou 147PM: Isotope del Prometio com massa atômica 147.
Propriedades do prometio
Estado físico
Cristais de sólidos metálicos soltos, cristais hexagonais.
Massa atômica
144.91
Ponto de fusão
1042 ºC
Ponto de ebulição
3000 ºC
Densidade
7,26 g/cm3
Propriedades quimicas
Pertence à família dos lantanídeos, lantanóides ou "terras raras", chamadas assim porque, na crosta terrestre, eles estão sempre na forma de seus óxidos. Fazem parte do período 6 da tabela periódica dos elementos.
Segundo fontes consultadas, o primeiro -ministro, como os outros Lantanids, reage diretamente com a água, lentamente fria, rapidamente ao aquecer, liberando hidrogênio (H2). Escurece rapidamente no ar e queima facilmente produzindo seu óxido.
Mais de 30 compostos prometores foram preparados e a maioria apresenta algum tipo de coloração. Seu status de oxidação nesses compostos é +3. Não forma cátions tetravalentes.
Formação de alguns compostos
Dissolvendo -o no ácido clorídrico (HCl) os formulários prometidos o PMCL3 que é amarelo e solúvel em água. Em ácido nítrico (HNO3) PM é gerado (não3)3 que é rosa e também solúvel em água.
Se uma solução contendo íons PM3+ é alcalizado com NH3, Ou seja, o pH é aumentado, os precipitados de hidróxido (PM (OH)3) marrom claro.
Pode servir a você: link iônico: características, como é formado e exemplosPM sulfato2(SW4)3 É levemente solúvel em água. Se o oxalato do prometio for aquecido, ele se torna o óxido de PM2QUALQUER3 branco ou lavanda.
Emissão radioativa
Emite radiação beta na forma de elétrons que deixam o núcleo de seus átomos. Ao emiti -lo, torna -se o elemento samário (SM). Por outro. O PM não emite raios gama.
Isótopos
Até agora, são conhecidos 14 isótopos de prometio, com massas atômicas que variam de 134 a 155. Todos são instáveis (radioativos), que o diferenciam de outros Lantanides.
O prometio-147 é o maior utilidade e tem meia-vida de 2,6 anos.
Isótopo com maior meia -vida
O isótopo de meia-vida mais longo é o prometio-145, com 17,7 anos, que decai por captura eletrônica, que consiste em um elétron atômico é combinado com um próton e forma um nêutron e um neutrino.
No entanto, é o único isótopo do PM que também pode sofrer desintegração alfa (emissão de 2 nêutrons). Isso ocorre porque possui 84 nêutrons e a emissão de 2 deles faz com que o prometio-141 com 82 nêutrons, que é uma configuração estável do núcleo. Mas este é um tipo de decadência que ocorre muito pouco.
Obtenção atual
Em 1963. Hoje ainda está se recuperando dessa maneira como sais de 147PM3+.
De acordo com certas fontes, também foi preparado nesses anos por redução de fluoreto (PMF3) Com vapor de lítio (Li). Também é preparado por redução de cloreto (PMCL3) Com cálcio (CA) a altas temperaturas.
Também pode ser obtido do neodímio-146. Este isótopo é submetido a bombardeios com nêutrons, para que cada átomo capture um nêutron e se torne neodímio-147. Este último leva cerca de 11 dias que sofre de desintegração beta, transformando-se em prometio-147.
Formulários
O isótopo 147 (147PM) é o que mais tem sido usado, sendo o único que pode ser encontrado comercialmente. Não emite raios gama e é fornecido na forma de óxido ou cloreto. No entanto, seu transporte e manipulação requerem proteção contra a radiação.
Pode servir a você: hidrólise: o que é e exemplos de reaçõesEle possuía alguns usos que hoje não possui mais, porque atualmente é usado em aplicativos especiais.
Em baterias
Prometio-147 é usado em baterias atômicas de longo prazo. Nesse caso, pequenos pedaços do PM são colocados na matriz de um semicondutor para converter emissões beta em eletricidade.
Esse tipo de baterias de energia nuclear pode fornecer energia por cerca de 5 anos e tem sido usada em todos os tipos de dispositivos, de mísseis a marcapassos, que são dispositivos colocados em pacientes com problemas cardíacos.
 Os marcapassos podem ter baterias de longa duração com base no prometio. Autor: 242799. Fonte: Pixabay.
Os marcapassos podem ter baterias de longa duração com base no prometio. Autor: 242799. Fonte: Pixabay. Em aplicações médicas
De acordo com certas fontes, o óxido do prometio é usado na medicina como fonte de radiação.
Na indústria
Foi usado para medir a espessura de alguns materiais, o que é feito medindo a radiação beta que passa pelas amostras.
Aplicações potenciais
Pode ser usado como uma fonte de raio X transportável, mas aparentemente esse aplicativo ainda não foi desenvolvido comercialmente.
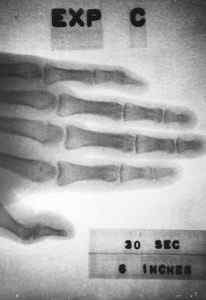 Imagem de raios-X obtida em 1963 com um pequeno dispositivo (aproximadamente 10 cm x 5 cm x 1 cm) contendo prometio-147. Energia.Domínio do governo / pub. Fonte: Wikimedia Commons.
Imagem de raios-X obtida em 1963 com um pequeno dispositivo (aproximadamente 10 cm x 5 cm x 1 cm) contendo prometio-147. Energia.Domínio do governo / pub. Fonte: Wikimedia Commons. Também serviria para fornecer energia ao espaço e sondas de satélite ou para fabricar dispositivos que permitam comunicação com submarinos.
Uso descontinuado em sinais de luz
Inicialmente, o prometio-147 foi usado para substituir o elemento de rádio nos mostradores luminosos, pois foi descoberto que o rádio era muito perigoso. Para isso, o PMCL foi misturado3 Com luminóforos, que brilham de amarelo esverdeado a azul quando a radiação do prometido (Beta Partículas) os afeta.
 Algumas dezenas de anos atrás, as agulhas dos relógios da pulseira podiam ser vistos no escuro por causa do brilho causado pela radioatividade do prometio. Autor: Monacocannes. Fonte: Pixabay.
Algumas dezenas de anos atrás, as agulhas dos relógios da pulseira podiam ser vistos no escuro por causa do brilho causado pela radioatividade do prometio. Autor: Monacocannes. Fonte: Pixabay. Esta propriedade foi usada em relógios ou mostradores de pulseira para brilhar no escuro. Também no botão de ignição de algumas lâmpadas fluorescentes. Além disso, não danificou os luminóforos, como é o caso de outras fontes de radiação beta, prolongando a vida útil dos dispositivos.
No entanto, quando foi descoberto que promissor também é perigoso, seu uso no mercado de objetos que brilham no escuro.
Riscos
O PM é um elemento radioativo, por isso deve ser manipulado com extrema cautela e com o devido proteção. Além das partículas beta que emite, elas podem impactar elementos com um número atômico principal e gerar raios X.
 As amostras prometidas devem ser transportadas dentro de um escudo espesso de chumbo para evitar os efeitos nocivos da radiação que eles emitem. Energia.Domínio do governo / pub. Fonte: Wikimedia Commons.
As amostras prometidas devem ser transportadas dentro de um escudo espesso de chumbo para evitar os efeitos nocivos da radiação que eles emitem. Energia.Domínio do governo / pub. Fonte: Wikimedia Commons. Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Promésimo - PM (elemento). Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Ganjali, m.R. et al. (2016). Introdução à série Lanthanide (de Lanthanum ao LOTETIUM). Promécio. Na série Lanthanides, determinação por vários métodos analíticos. Recuperado de cientedirect.com.
- Choppin, g. et al. (2013). A origem do universo e nucleossíntese. Captura lenta de nêutrons. Em radioquímica e química nuclear (quarta edição). Recuperado de cientedirect.com.
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Sociedade Real de Química. (2020). Promécio. RSC se recuperou.org.
- « Variáveis de pesquisa tipos, características e exemplos
- Métodos de separação de misturas homogêneas »

