Métodos de separação de misturas homogêneas
- 2538
- 380
- Mr. Reginald Lindgren
O Métodos de separação de misturas homogêneas São todos aqueles que, sem usar reações químicas, permitem obter os componentes ou solutos que integram a mesma fase; isto é, de um líquido, sólido ou gás.
Tais misturas homogêneas consistem em soluções, nas quais as partículas de soluto são pequenas demais para poder distingui -las com a olho nua. Eles são tão pequenos que não há filtros estreitos ou seletivos para mantê -los enquanto a solução os transfere. Técnicas como centrifugação ou magnetização também ajudam sua separação.
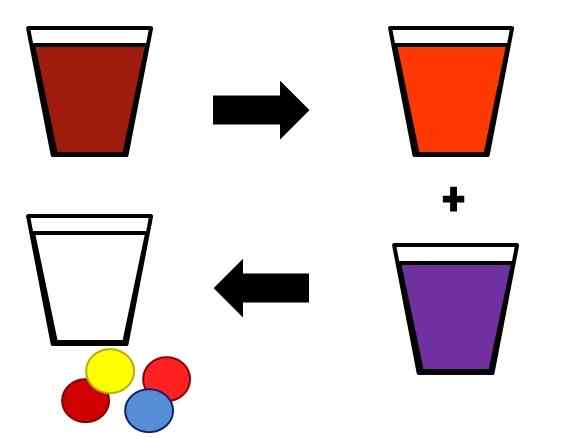 Exemplo ilustrativo de como as misturas homogêneas podem se separar nos palcos. Fonte: Gabriel Bolívar.
Exemplo ilustrativo de como as misturas homogêneas podem se separar nos palcos. Fonte: Gabriel Bolívar. Um exemplo de como as soluções são separadas em seus componentes é mostrada acima. A mistura inicial (marrom) é separada em dois componentes, igualmente homogêneos (laranja e roxo). Finalmente, das duas misturas resultantes, o solvente (branco) e os quatro pares de solutos (vermelho-amarelo e azul vermelho) são obtidos.
Entre os métodos ou técnicas de separação de soluções, temos evaporação, destilação, cromatografia e cristalização fracionária. Dependendo da complexidade da mistura, mais de um desses métodos deve ser usado até quebrar a homogeneidade.
[TOC]
Os principais métodos de separação de misturas
- Evaporação
 A evaporação é o método mais simples para separar as misturas homogêneas de um único soluto.
A evaporação é o método mais simples para separar as misturas homogêneas de um único soluto. As misturas homogêneas mais simples são as soluções onde um único soluto foi dissolvido. Por exemplo, na imagem superior, há uma solução colorida devido à absorção e reflexão da luz visível com as partículas de seu soluto.
Se se mexe bem durante sua preparação, não haverá regiões mais claras ou sombrias que outras; Eles são todos iguais, uniformes. Essas partículas coloridas não podem ser separadas do solvente por qualquer método mecânico; portanto, você precisará de energia no calor (triângulo vermelho) para alcançá -lo.
Pode atendê -lo: dissulfeto de carbono (CS2): estrutura, propriedades, usos, riscosAssim, a solução colorida é aquecida em aberto para acelerar e permitir a evaporação do solvente fora de seu recipiente. À medida que acontece, o volume que separa as partículas de soluto diminui e, portanto, suas interações aumentam e acabam lentamente sedimentando.
O resultado final é que o soluto colorido permanece na parte inferior do recipiente e o solvente evaporou completamente.
A inconveniência com a evaporação é que, em vez de separar solutos, seu objetivo é eliminar o solvente aquecendo -o ao seu ponto de ebulição. O sólido restante pode ser composto de mais de um soluto e, portanto, é necessário de outros métodos de separação para defini -lo em seus componentes isolados.
- Destilação
 Destilação
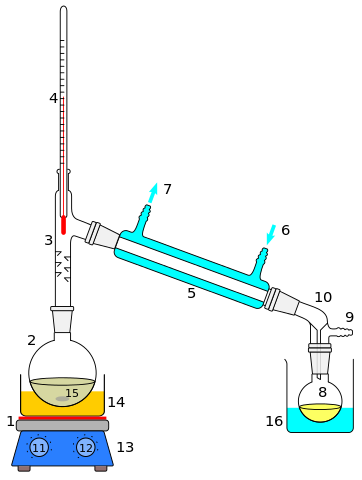
Destilação A destilação é talvez o método de separação de soluções ou misturas homogêneas. Seu uso se estende a sais ou metais fundidos, gases condensados, misturas de solventes ou extratos orgânicos. O soluto é na maioria das vezes um líquido, cujo ponto de ebulição difere em vários graus em relação ao solvente.
Quando a diferença entre esses pontos de ebulição é alta (maior que 70 ºC), a destilação simples é usada; E se não, então uma destilação fracionada é realizada. Ambas as destilações têm vários conjuntos ou desenhos, bem como uma metodologia diferente para misturas de diferentes natureza química (volátil, reativa, polar, apolar, etc.).
Na destilação, o solvente e os solutos são preservados, e essa é uma de suas principais diferenças em relação à evaporação.
No entanto, a rotavaporação combina esses dois aspectos: uma mistura líquido ou líquido líquido, como o de um óleo dissolvido e miscível, eles aquecem até que o solvente seja removido, mas é coletado em outro recipiente enquanto o sólido ou o O petróleo permanece no recipiente inicial.
Pode atendê -lo: tabela periódica, para que éDestilação aérea
O ar do condensado é submetido a destilação fracionada criogênica para separar oxigênio, nitrogênio, argônio, neon, etc. O ar, uma mistura gasosa homogênea, é transformada em um líquido onde o nitrogênio, porque é o componente majoritário, atua em teoria como um solvente; E os outros gases, também condensados, como solutos líquidos.
- Cromatografia
A cromatografia, diferentemente de outras técnicas, não pode fornecer rendimentos ou remotamente semelhante; isto é, não é útil processar uma mistura inteira, mas uma fração insignificante do mesmo. No entanto, as informações que ele fornece são analiticamente valiosas, pois identifica e classifica as misturas com base em sua composição.
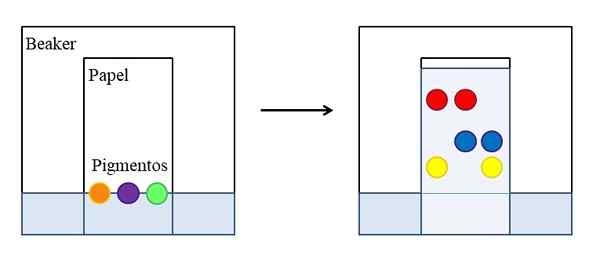 Cromatografia em papel ou camada fina. Fonte: Gabriel Bolívar.
Cromatografia em papel ou camada fina. Fonte: Gabriel Bolívar. Existem diferentes tipos de cromatografias, mas o mais simples, que é explicado nas escolas ou cursos de pré -universidade, é o do artigo, cujo princípio é o mesmo que o desenvolvido em uma camada fina de um material absorvente (geralmente sílica gel ).
A imagem superior mostra que, em um copo, cheio de água ou solvente específico, é colocado um papel que foi marcado uma linha de referência com gotas ou pontos de três pigmentos selecionados (laranja, roxo e verde). O copo permanece fechado para que a pressão seja constante e saturada dos vapores de solvente.
Então, o líquido começa a subir pelo papel e arrastar os pigmentos. As interações pigmentos-pios não são todas iguais: alguns são mais fortes e outros mais fracos. Quanto mais afinidade o pigmento sente pelo papel, menos ele subirá através do papel em relação à linha que foi inicialmente marcada.
Pode atendê -lo: velocidade constantePor exemplo: o pigmento vermelho é aquele que parece menos afinidade pelo solvente, enquanto o amarelo mal ascendeu porque o papel o mantém mais. Dizem então que o solvente é a fase móvel e o artigo da fase estacionária.
- Cristalização fracionária
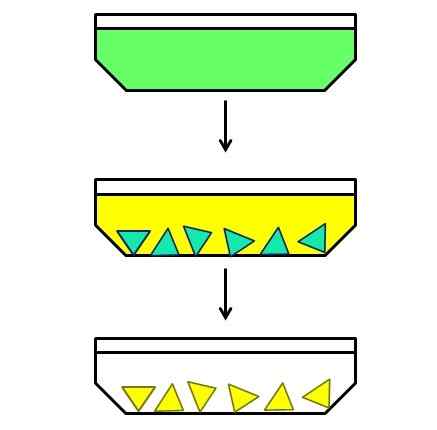 Exemplo ilustrativo de cristalização fracionária. Fonte: Gabriel Bolívar.
Exemplo ilustrativo de cristalização fracionária. Fonte: Gabriel Bolívar. E finalmente você tem cristalização fracionária. Esse método talvez possa catalogar como um híbrido, porque começa com uma mistura homogênea para acabar com um heterogêneo. Por exemplo, suponha que exista uma solução na qual um sólido verde tenha sido dissolvido (imagem superior).
Partículas verdes são pequenas demais para se separar manualmente ou mecanicamente. É também que o sólido verde é uma mistura de dois componentes e nem um único composto desta cor.
Então, uma solução é aquecida e deixada em repouso durante o resfriamento. Acontece que os dois componentes, embora muito relacionados entre si, seu solvente solvente é um pouco diferente; Portanto, um dos dois começará a cristalizar primeiro e depois o outro.
O componente verde-azul (no meio da imagem) é o primeiro a cristalizar, enquanto o componente amarelo ainda está dissolvido. Sendo cristais verdes azuis, eles estão quentes antes que os cristais amarelos apareçam. Então, à medida que o solvente esfria um pouco mais, o amarelo cristaliza e outra filtração é feita.
Assuntos de interesse
Métodos de separação da mistura.
Métodos de separação de misturas heterogêneas.
Misturas: componentes e tipos.
Misturas homogêneas.
Misturas heterogêneas.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Chelsea Schuyler. (2019). Cromatografia, destilão e filtração: métodos de separação de misturas. Estudar. Recuperado de: estudo.com
- Fundação CK-12. (16 de outubro de 2019). Métodos para separar misturas. Química Librettexts. Recuperado de: química.Librettexts.org
- Boa ciência. (2019). Separação de misturas. Recuperado de: Goodscience.com.Au
- Clark Jim. (2007). Cromatografia em camada fina. Recuperado de: Chemguide.co.Reino Unido
- « Estrutura prometida (PM), propriedades, obtenção, usos
- Características, funções e exemplos da função metalinguística »

