Processos termodinâmicos
- 4876
- 1279
- Orlando MacGyver
Explicamos quais são os processos termodinâmicos, os tipos que existem e damos vários exemplos
Quais são os processos termodinâmicos?
O Processos termodinâmicos São processos nos quais um sistema termodinâmico em estudo passa por uma mudança de estado. Durante essa mudança de estado, ocorre um movimento energético dentro do sistema ou entre o sistema e o ambiente. De fato, esta é a razão pela qual eles são chamados Processos termodinâmicos, já que térmica- Refere -se ao aquecimento (uma forma de energia) e -dinâmico Refere -se ao movimento.
Por mudança de estado, não é necessariamente referido de sólido para fluido ou fluido a gás não é feito (embora esses também sejam processos termodinâmicos), mas a uma mudança nas funções do estado, ou seja, nas variáveis que definem o estado do estado do estado de sistema, como temperatura, volume e pressão.
Os processos termodinâmicos ocorrem em todos os lugares. De fato, praticamente qualquer processo de mudança para o qual um sistema pode ser definido pode ser considerado um processo termodinâmico. De um sorvete derretendo até a operação de um motor de combustão interna ou a operação de um liquidificador.
Tipos de processos termodinâmicos
Há uma grande variedade de processos termodinâmicos, por isso é necessário classificá -los para facilitar seu estudo. Os principais critérios para classificar os processos termodinâmicos são:
- De acordo com a taxa de câmbio no sistema
- De acordo com a função de estado que permanece constante
- De acordo com a Segunda Lei da Termodinâmica
1. Tipos de processos termodinâmicos de acordo com a taxa de câmbio
-
Mudanças no sistema
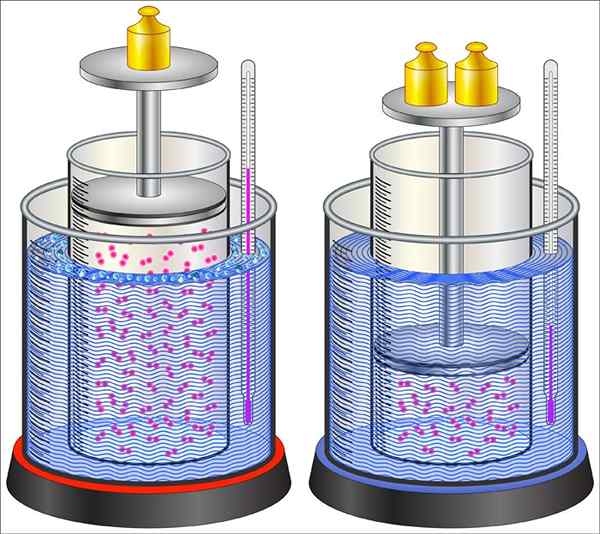
Esse tipo de processo termodinâmico é caracterizado pela passagem do sistema de um estado inicial para um final, ambos definidos por um número adequado de variáveis de estado. Nesse tipo de processo, o sistema está em equilíbrio termodinâmico, tanto no estado inicial quanto no estado final e a mudança é causada por um agente externo.
Pode servir a você: Petri Box: característica, funções, use exemplos Exemplo do processo de mudança no sistema, neste caso uma mudança de estado ocorre no gás que está dentro do cilindro
Exemplo do processo de mudança no sistema, neste caso uma mudança de estado ocorre no gás que está dentro do cilindro O equilíbrio termodinâmico é uma condição macroscópica, o que implica que o sistema não sofrerá nenhuma mudança no tempo, a menos que seja perturbada por alguma força externa. Isso pode consistir na contribuição da energia na forma de calor, trabalho, entre outros.
Deve -se notar que, ao estudar processos de mudança no sistema, muitas vezes (embora nem sempre) o processo em si não seja importante, mas apenas o estado inicial e o estado final.
-
Processos cíclicos
Em muitas situações, especialmente na construção de máquinas com base em processos termodinâmicos, o sistema é submetido a um conjunto de processos de mudança de estado que começam a partir de um estado inicial, passam por um conjunto de estados intermediários e terminam novamente no mesmo estado inicial original, Concluindo assim um ciclo.
 Os processos dentro do cilindro de um mecanismo de combustão interna são processos cíclicos, que são continuamente repetidos para manter o motor funcionando
Os processos dentro do cilindro de um mecanismo de combustão interna são processos cíclicos, que são continuamente repetidos para manter o motor funcionando Os processos cíclicos não produzem uma alteração líquida no estado do sistema (como eles começam e terminam no mesmo estado), mas dependendo de como o ciclo é realizado, eles podem produzir a transferência de energia líquida de uma parte do ambiente para outro ou entre dois outros sistemas separados.
Um exemplo de processos cíclicos é o que acontece dentro dos pistões de um mecanismo de combustão interna, bem como o conjunto de processos que ocorrem dentro do compressor de sistemas de resfriamento.
-
Processos de fluxo
Os processos de fluxo diferem dos outros dois tipos de processos, nos quais o sistema é composto pelo assunto que está em um determinado momento dentro de um recipiente através do qual um fluxo constante de matéria passa.
Pode atendê -lo: etileno glicol: propriedades, estrutura química, usos Tubos em uma fábrica na qual os processos de fluxo ocorrem
Tubos em uma fábrica na qual os processos de fluxo ocorrem Esses tipos de processos termodinâmicos são comumente usados na engenharia, e as propriedades de interesse são, em geral, as taxas de entrada e saída de energia de e para o contêiner, como é atravessado pelo assunto que pode ser um líquido puro, uma solução, a mistura reagente, etc.
2. Tipos de processos termodinâmicos de acordo com a função de estado que permanece constante
Para facilitar sua análise e interpretação, muitos processos termodinâmicos são realizados mantendo uma ou mais variáveis constantes. Dessa forma, os efeitos no sistema de mudança de um pequeno número de variáveis podem ser determinados. Isso faz com que diferentes tipos de sistemas termodinâmicos possam ser definidos de acordo com a qual a variável permanece constante. Estes são:
-
Processos isotérmicos (t = ctte)
São aqueles processos em que a temperatura permanece constante. Apesar de não parece intuitivo, o fato de a temperatura não mudar não significa que não haja transferência de calor. Durante esses processos, não há mudança na energia interna do sistema.
-
Processos isocóricos (v = ctte)
São os processos que ocorrem sem mudança de volume. Em geral, eles ocorrem em sistemas fechados com paredes rígidas (que não podem ser deformadas). Eles também são chamados de isovolumétricos e isométricos. Eles são caracterizados por não envolver o trabalho de expansão P-V.
-
Processos isobáticos (P = CTTE)
Talvez seja o tipo mais comum de processo termodinâmico com o qual encontramos nossas vidas diárias. Eles são caracterizados por pressão constante.
-
Processos adiabáticos (q = 0)
Estes são os processos que ocorrem sem transferência de calor. Eles geralmente são confundidos com processos isotérmicos, pois, como não há transferência de calor, muitos assumem que não há mudança de temperatura. No entanto, isso não é assim.
-
Processos isoentrópicos (s = ctte)
São processos nos quais a entropia do sistema permanece constante.
-
Processos isoentários (H = CTTE)
São aqueles processos em que a entalpia do sistema permanece constante.
Pode atendê -lo: tiossulfato de sódio (Na2S2O3)3. Tipos de processos termodinâmicos de acordo com a segunda lei da termodinâmica
A segunda lei é usada para prever a espontaneidade dos processos termodinâmicos. Com base nisso, os seguintes tipos de processos podem ser distinguidos:
-
Processos espontâneos
Eles são aqueles que implicam um aumento na entropia do universo e, portanto, ocorrem espontaneamente (naturalmente).
-
Processos reversíveis
Esse tipo de processo não envolve mudanças na entropia do universo e, portanto, está em equilíbrio. São processos reversíveis que podem ocorrer em ambas as direções.
-
Processos irreversíveis
São aqueles que implicam uma diminuição na entropia do universo e, portanto, não acontecem naturalmente do estado inicial até o fim, mas na direção oposta.
Exemplos de processos termodinâmicos
- O ciclo de Carnot é um Processo cíclico de 4 estágios, nos quais sistemas de refrigeração, como referências, são baseados.
- A evaporação de uma poça de água é um exemplo de um Processo termodinâmico irreversível.
- A formação de geada em um freezer é um Processo irreversível.
- O resfriamento de um gás que é pressurizado ao deixá -lo escapar da garrafa é um exemplo de um Processo aproximadamente adiabático.
- A combustão do gás da cozinha ocorre no ar a pressão atmosférica constante, por isso é considerado um processo isobárico.
- O aquecimento de água em um aquecedor a gás é um Processo de fluxo, Uma vez que a água entra e deixa o cano a uma taxa constante, absorve o calor da combustão de gás.

