Propriedades peróxidas, nomenclatura, usos, exemplos
- 3049
- 303
- Ralph Kohler
O peróxidos São todos os compostos químicos que contêm o grupo peroxo, O-O, covalentemente ligados a átomos de carbono ou outros grupos funcionais, ou em forma iônica, como o ânion peróxido, ou22-. O acima é representado graficamente na imagem abaixo. Nele, o grupo O-O se destaca com uma cor azul.
Pode haver peróxidos orgânicos, como diabilperóxidos (r1-O-o-r2), Hidroperóxidos (r-o-o-h), perácidos (rco-o-o-h) e peésstres (r1Co-o-o-r2). Também temos peróxidos inorgânicos, como peróxidos de metal (Mn+QUALQUER22-) e peróxido de hidrogênio (H-O-H). O último é o mais conhecido de todos, recebendo o nome de peróxido de hidrogênio.
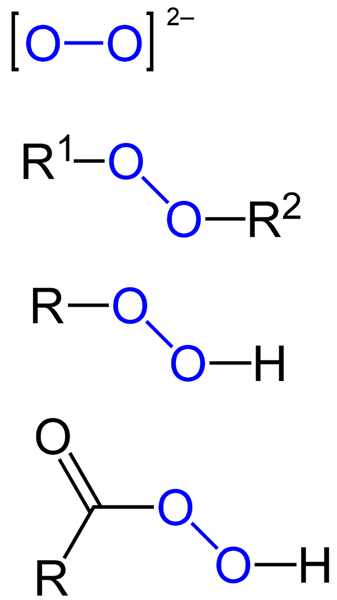 Fórmulas para diferentes tipos de peróxidos que existem. Fonte: Jü / domínio público
Fórmulas para diferentes tipos de peróxidos que existem. Fonte: Jü / domínio público Todos os peróxidos compartilham em comum a propriedade de serem substâncias muito reativas e oxidantes e, em alguns casos, explosivas. A menos que não sejam especificados sintetizando -os, são considerados impurezas indesejadas e perigosas para muitos processos industriais e para síntese laboratorial.
Peróxidos em geral são excelentes agentes oxidantes, branqueamento, bactericidas e ativadores de polimerizações por meio de formação de radicais livres. É por isso que eles geralmente são reagentes ou aditivos muito úteis na indústria de polímeros, bem como na indústria de alimentos para acelerar oxidações e eliminar bactérias.
[TOC]
Propriedades de peróxido
Estrutura
As estruturas de peróxido se concentram em torno do grupo O-O. Cada átomo de oxigênio tem uma hibridação SP3, Então os links -não -não descansam no mesmo avião. Por exemplo, para peróxido de hidrogênio, h-o-h, o ângulo formado entre os dois h é 115.5º, que mostra que os quatro átomos não estão em um avião.
As distorções deste e de outros ângulos dependerão da identidade dos outros fragmentos moleculares ligados ao grupo O-O.
Pode atendê -lo: Gibbs Free Energy: Units, como é calculado, exercícios resolvidosPor outro lado, peróxidos orgânicos e inorgânicos (exceto o metálico) podem ser reconhecidos a olho nu se o grupo O-O for detalhado em sua estrutura, como dois óculos com uma "boca". Dessa forma, qualquer peróxido é imediatamente identificado com uma única visão de sua estrutura.
Reatividade
O link O-O é relativamente fraco em comparação com outros links como C-H ou C-O. É por isso que tende a quebrar ou fragmentar a produzir radicais oxigenados altamente reativos.
Eles são por causa desses radicais que os peróxidos são classificados como substâncias reativas e perigosas, pois podem danificar os tecidos e qualquer matéria orgânica em geral.
Ação oxidante
Os peróxidos são agentes oxidantes poderosos, buscando ganhar elétrons do meio ambiente para se transformar em água, oxigênio ou hidróxido. Por exemplo, o peróxido de hidrogênio é um agente oxidante mais forte que o mesmo permanganato de potássio.
Esta ação oxidante é usada para detectá -los através de sua reação com sulfato ferroso e tiocianato de potássio:
Peróxido +fé2+ + Scn- → Fe (SCN)n(3-n)- (N = 1 a 6).
O complexo formado entre fé3+ e o scn- É vermelho no sangue, então a observação desta cor corresponde a um teste positivo para a presença de peróxidos na amostra.
Sensibilidade
Os peróxidos são substâncias sensíveis a altas temperaturas e luz solar. Portanto, eles devem ser armazenados em locais seguros e em recipientes plásticos e opacos, para que a luz não os afete diretamente.
Nomenclatura
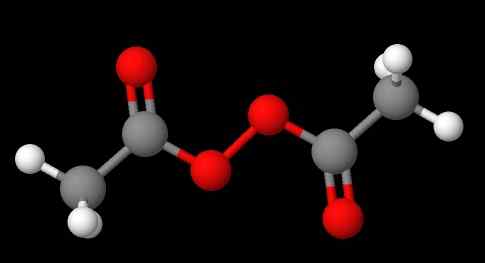
A nomenclatura de peróxidos depende de que tipo eles pertencem. Em geral, muitos são nomeados mencionando 'peróxido de' seguido pelos substituintes r em ordem alfabética. Por exemplo, composto ch3C (O) OOC (O) CH3 (Imagem inferior) é chamada de diacetil ou peróxido de acetil, pois possui um grupo acetil em cada extremidade.
Pode servir a você: sulfato de sódio (Na2So4): estrutura, propriedades, usos, obtenção Peróxido de diacetil. Fonte: Gabriel Bolívar via Molview.
Peróxido de diacetil. Fonte: Gabriel Bolívar via Molview. O composto c6H5C (O) OOC (O) C6H5 (Imagem inferior), por outro lado, é chamado de Dibenzoílo ou Peróxido de Benzoílo, pelas mesmas razões declaradas no parágrafo anterior.
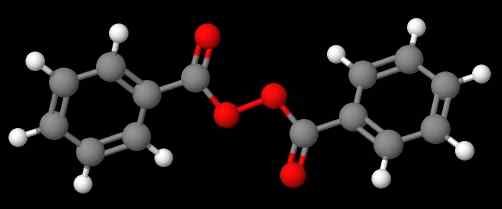 Peróxido de benzoíla. Fonte: Gabriel Bolívar via Molview.
Peróxido de benzoíla. Fonte: Gabriel Bolívar via Molview. Enquanto isso, composto C6H5C (O) OOC (O) CH3 é chamado de peróxido de acetil benzolelo. Desta vez, o substituinte acetil é mencionado primeiro para começar com a letra 'a'. Outro exemplo é CH3CH2Ooc6H5, chamado peróxido de etila fenil.
Da mesma forma, prossiga com hidroperóxidos. Por exemplo, Cho3OOH é chamado de hidroperóxido de metila.
Treinamento
Alguns peróxidos podem ser formados diretamente pela exposição da substância em questão com o oxigênio do ar, assistido ou não com catalisadores de metal. Eles também podem se formar expondo a substância ao ozônio sob certas condições, realizando a reação de ozonólise.
Outra rota sintética é reagir peróxido de hidrogênio com um alquilorsulfato:
R2SW4 + H2QUALQUER2 → R-O-R +H2SW4
Para sintetizar ou formar peróxidos diocílicos ou até peróxidos cíclicos.
Enquanto isso, vários dos métodos para formar peróxidos de metal são baseados em oxigenar seus respectivos óxidos metálicos, de modo que eles "oxigênio" e deixam de ser MO (Mn+QUALQUER2-) amor2 (Mn+QUALQUER22-).
Usos de peróxidos
Iniciadores de polimerizações
Os peróxidos, especialmente os peróxidos orgânicos, são adicionados às médias de reação para a síntese de infinitos de plásticos e materiais como poliestireno, silicone, epóxi e resinas acrílicas, cloreto de polivinil, fibra de vidro, entre outros.
Isso ocorre porque eles sofrem decomposições térmicas para se tornarem radicais livres oxigenados, que por sua vez desencadeiam e catalisam polimerizações. Portanto, eles são desejáveis na indústria de polímeros.
Pode servir a você: fração molar: como é calculado, exemplos, exercíciosAlguns dos peróxidos usados como iniciadores são o peróxido de metil ctona (MEK) e peróxido de acetona.
Alvejante e desinfetantes
Peróxidos são agentes de branqueamento, usados para clareamento de papel e polpa de farinha. Eles também são agentes desinfetantes, totalmente eficazes, mas agressivos em termos de extermínio de bactérias. O exemplo clássico corresponde ao peróxido de hidrogênio, destinado a soluções diluídas (3%) para desinfetar feridas.
Agentes oxidantes
Os peróxidos também são agentes oxidantes, então encontram muitos usos na síntese orgânica de substâncias muito oxigenadas.
Fontes de oxigênio
Embora não esteja entre seus principais usos, os peróxidos também podem servir como fontes de oxigênio em algumas de suas quebras. É o caso, novamente, do peróxido de hidrogênio.
Exemplos de peróxidos
Finalmente, alguns exemplos de peróxidos serão listados, orgânicos ou inorgânicos, com suas fórmulas e respectivos nomes:
-H2QUALQUER2: Hidrogênio ou peróxido de hidrogênio
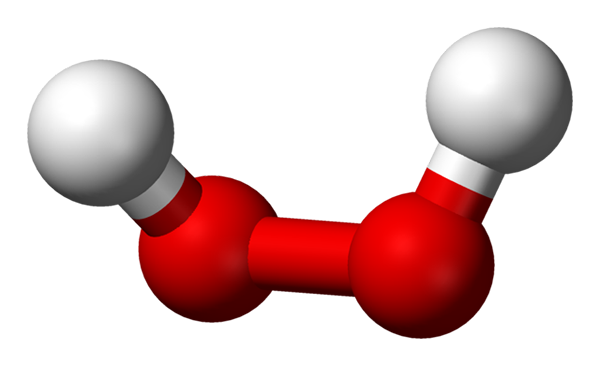 Molécula de peróxido de hidrogênio representada com um modelo de esferas e barras. Fonte: Benjah-BMM27 via Wikipedia.
Molécula de peróxido de hidrogênio representada com um modelo de esferas e barras. Fonte: Benjah-BMM27 via Wikipedia. -N / D2QUALQUER2: peróxido de sódio
-Feixe2: peróxido de bário
-C6H5C (cap3)2Ooh: hidroperóxido de Cummeno
-(NH4)2S2QUALQUER8: Persulfato de amônio
- Ho3Sooso3H: ácido peroxidisulfúrico
-(CH3)3COOC (cap3)3: Peróxido de ditert-butil
Referências
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10º Edição.). Wiley Plus.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Peróxido orgânico. Recuperado de: em.Wikipedia.org
- Elsevier b.V. (2020). Peróxido. Cientedirect. Recuperado de: ScientEdirect.com
- Desenvolvimento de Química Avançada. (s.F.). Álcoois, fenóis e seus derivam:
- Peróxidos Regra C-218. Recuperado de: ACDLABS.com
- Vol'nov i.Yo., Petrocelli a.C. (1966) Classificação e nomenclatura de compostos inorgânicos de peróxido. In: Petrocelli a.C. (Eds) peróxidos, superóxidos e ozonides de metais alcalinos e alcalinos da terra. Springer, Boston, MA.
- « Baja Típica Califórnia Sur para homens e mulheres (descrição)
- Propriedades de vendas halóides, nomenclatura, como elas são formadas, exemplos »

