Propriedades de vendas halóides, nomenclatura, como elas são formadas, exemplos

- 2561
- 784
- Terrell Stokes
As sais halóides Eles são compostos binários formados por um metal e um não -metal, sem nenhum outro elemento. Esses sais são formados pela reação de neutralização entre um ácido hidracia com uma base. Por exemplo: a reação entre ácido clorídrico (HCl) com hidróxido de sódio (NaOH) para formar cloreto de sódio (NaCl).
Os sais haloidais também são formados pela reação de uma hidratia com um metal. Por exemplo: a reação de magnésio com ácido clorídrico para formar cloreto de magnésio (MGCL2). Como visto, os cloretos são os sais halóides mais representativos. No entanto, eles não são os únicos.
 Halita, cloreto de sódio em seu estado natural, é o principal exemplo de um sal halóide. Fonte: http: // GL.Wikipedia.org/w/índice.Php?Título = Usuário: Shinichi / Domínio Público
Halita, cloreto de sódio em seu estado natural, é o principal exemplo de um sal halóide. Fonte: http: // GL.Wikipedia.org/w/índice.Php?Título = Usuário: Shinichi / Domínio Público Os sais halóides, de acordo com algumas definições, entendem os compostos que eles contêm em sua estrutura de halogênio; Isto é: fluorina, cloro, bromo e iodo, então eles são considerados sinônimos de halogenetos ou halogenuros.
Da mesma forma, dentro dos sais halóides são incluídos, por alguns autores, compostos formados pela união de um metal com um elemento que está usando sua valência negativa, incluindo: carbonetos, nitretos, fosfuros, sulfídeos, selniuros, arseniuros, etc. Eles também contam como sais halóides sempre que consistem em dois elementos apenas.
[TOC]
Propriedades de vendas halóides
Os sais halóides são um grupo de compostos cujas propriedades são difíceis de estabelecer.
Fortes ligações iônicas
Em geral, eles consistem em sólidos com fortes ligações iônicas entre íons de dois elementos: M+X-, onde m+ corresponde ao cátion metálico e x- o ânion derivado de não -metal.
Altos pontos de fusão, ebulição e sublimação
Eles geralmente têm pontos de fusão, ebulição e sublimação muito alta, devido precisamente à força de sua estrutura cristalina.
Pode atendê-lo: DAPI (4 ', 6-diamidino-2-fenilindol): características, fundamento, usoCondução de eletricidade
Em estado sólido, eles são maus condutores de eletricidade, mas em solução aquosa quando ionizam, ou quando se fundem, bons motoristas se tornam.
Aparência
São sólidos cristalinos que, quando fragmentados em pó, podem se tornar uma coloração branca. No entanto, muitos sais halóides podem ter uma coloração diferente. Por exemplo, o cloreto de níquel é verde, enquanto o cloreto férrico tem uma coloração oscilante entre verde e vermelho.
Solubilidade
A maioria dos sais de Haluros é solúvel em água, com exceção de prata, chumbo (ii) e halogenetos de mercúrio (i).
Cheiro
Porque eles não são compostos voláteis, os sais halóides não apresentam odores fortes. Além disso, devido à sua composição, eles podem ser de sabores azedos, salgados, amargos ou doces.
Nomenclatura
Os sais halóides são nomeados colocando o nome do ânion com o sufixo auroque, seguido pelo nome do metal diretamente, precedido pela conjunção de. No caso de o metal ter mais de uma valência, o metal é colocado com o sufixo urso ou ico, Dependendo de sua Valência.
O nome do metal também pode ser colocado sem sufixo e com o número de oxidação entre parênteses.
Por exemplo: cloreto de ferro (iii), ou cloreto férrico, FECL3.
Como os sais halóides são formados?
Os sais halóides são formados principalmente por três reações: neutralização, reação ácida com um metal e a reação de um metal com um metal ou uma atuação não -metal com uma valência negativa.
Reação neutralizadora
É a reação de um ácido com uma base, produzindo sal e uma molécula de água. Por exemplo:
Hcl +NaOH → NaCl +h2QUALQUER
Este exemplo foi mencionado ao príncipe.
Reação de um ácido com um metal
Um ácido forte pode reagir com um metal, originando um sal e a liberação de hidrogênio (h2). Por exemplo: o ácido clorídrico reage com zinco (Zn) para formar cloreto de zinco (ZNCL2):
Pode atendê -lo: química analíticaZn +HCl → ZnCl2 + H2
Combinação de um metal com um metal ou um não -metal
Esses sais halóides resultam da combinação de um metal com um metal ou um não -metal de halogênios. Por exemplo: o fosfuro de alumínio combina fósforo com valência -3, com alumínio com valência +3. Agora, essa "combinação" é devido a reações de produção específicas para cada sal.
Usa/aplicações
Halogenuros de metal
Halogenuros de metal são usados em lâmpadas de alta intensidade, como lâmpadas modernas. Eles também são usados em estufas ou climas de chuva para complementar a luz natural. Os haletos de prata são usados em filmes e papéis fotográficos.
Cloreto de cálcio
 Aparência de cloreto de cálcio
Aparência de cloreto de cálcio O cloreto de cálcio é usado como fonte de cálcio no tratamento de águas residuais. Também é usado como fonte de cálcio através de sua eletrólise. É usado no tratamento de arritmias cardíacas e em casos de hipocalcemia grave.
Cloreto férrico
O cloreto férrico é usado no tratamento de águas residuais e purificação de água. Também é usado para gravar ou optar por cobre e intervir como um catalisador no processo de síntese de cloreto de vinil.
Cloreto e brometo de potássio
O cloreto de potássio é usado como fertilizante e no tratamento de hipocalemia ou hipocalemia. O brometo de potássio, por outro lado, foi usado como anticonvulsivo e atualmente é usado na indústria farmacêutica e como um curativo.
Cloreto e sulfeto de sódio
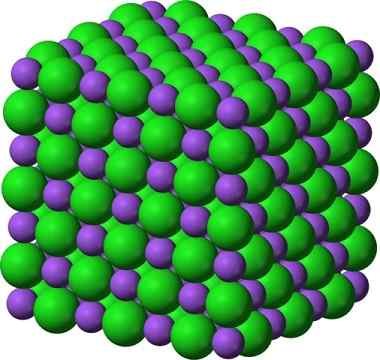
 A estrutura cristalina de cloreto de sódio, NaCl, um composto iônico típico. As esferas __ roxas representam cátions de sódio, Na +, e as esferas verdes __ representam cloreto de ancies, Cl-.
A estrutura cristalina de cloreto de sódio, NaCl, um composto iônico típico. As esferas __ roxas representam cátions de sódio, Na +, e as esferas verdes __ representam cloreto de ancies, Cl-. O cloreto de sódio é usado como um sabor alimentar, na conservação da carne, como anti -séptico, em hiponatremia grave, etc. O sulfeto de sódio é usado em reatores nucleares na produção de água pesada, na eliminação dos cabelos de peles e na fabricação de borrachas, corantes e pinturas.
Pode servir a você: óxido de alumínio: estrutura, propriedades, usos, nomenclaturaFosfuros e Nituros
O fosfuro de alumínio é usado como um semicondutor de banda larga e como inseticida. Enquanto isso, o gálio nituro é usado como um semicondutor.
Exemplos de sais halóides
Além dos exemplos mencionados na seção anterior, outros sais halóides com suas respectivas fórmulas e nomes:
-NaCl: cloreto de sódio
-KCL: cloreto de potássio
-CACL2: Cloreto de cálcio
-Mgcl2: Cloreto de magnésio
-CSCL: cloreto de césio
-Bacl2: Cloreto de bário
-FECL2: Cloreto ferroso
-FECL3: Cloreto férrico
-Nicl2: Clorele níquel
-CUCL: Cloreto Cuproso
-CUCL2: Cloreto cúprico
-AGCL: cloreto de prata
-ZnCl2: Cloreto de zinco
-CDCL2: Cloreto de cádmio
-Hgcl2: Cloreto mercúrico
-Alcl3: Cloreto de alumínio
-NABR: brometo de sódio
-KBR: brometo de potássio
-CSBR: brometo de césio
-CDBR: brometo de cádmio
-Mgbr2: Brometo de magnésio
-Srbr2: Brometo de estrôncio (ii)
-Ki: Potássio Yoduro
-NAI: iodeto de sódio
-CSI: Césio Yoduro
-Todos3: Iodeto de alumínio
-PIB2: Iodeto de chumbo (ii)
-Naf: fluoreto de sódio
-Lif: Fluoreto de lítio
-Caf2: Fluoreto de cálcio
-Ptf2: Fluoreto de platina (II)
-Nas2: Sulfeto de sódio
-Li4C: carboneto de lítio
-Mg2C: carboneto de magnésio
-ALP: fosfuro de alumínio
-Sim3N4: Silicon nitro
-Tin: titanium nitruro
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Julián Pérez Porto e María Merino. (2016). Definição de sais halóides. Definição.de. Recuperado de: definição.de
- James p. Birk. (5 de junho de 2019). Halide Ins. Química Librettexts. Recuperado de: química.Librettexts.org
- Wikipedia. (2020). Haloga. Recuperado de: em.Wikipedia.org
- « Propriedades peróxidas, nomenclatura, usos, exemplos
- Características do termohigômetro, funções, peças, usos »

