Estrutura da pepsinogênio, funções, tipos, síntese
- 903
- 184
- Lonnie MacGyver
Ele Pepsinogênio É o zimogênio da pepsina, uma das principais enzimas hidrolíticas encarregadas da realização da digestão de proteínas no estômago de mamíferos. Zimogênios ou pró -enzimas são precursores enzimáticos inativos, ou seja, não conseguem catalisar as reações realizadas por suas formas ativas.
Sua ativação depende de mudanças na estrutura tridimensional da proteína que dá origem à formação de um sítio ativo funcional. Essas mudanças, na maioria dos casos, coincidem com a ruptura proteolítica de um segmento de proteínas.
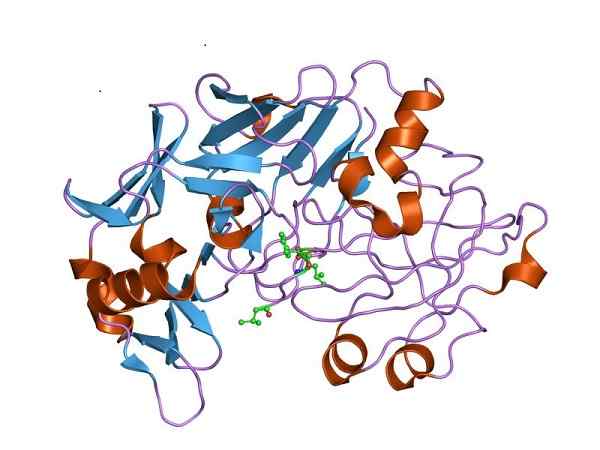
 Estrutura tridimensional da pepsina, a forma cataliticamente ativa de pepsinogênio. Por Jawahar Swaminathan e funcionários do MSD do Instituto Europeu de Bioinformática [Domínio Público (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons
Estrutura tridimensional da pepsina, a forma cataliticamente ativa de pepsinogênio. Por Jawahar Swaminathan e funcionários do MSD do Instituto Europeu de Bioinformática [Domínio Público (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons Portanto, a pepsinogênio deve experimentar mudanças estruturais para adquirir a atividade da peptidase necessária e favorecer a digestão de proteínas no estômago, após a ingestão de alimentos.
[TOC]
Estrutura
A pepsinogênio é uma proteína de aminoácidos 371 pertencente à grande família de proteinases aspárticas, caracterizada pela apresentação de resíduos de ácido aspártico em seu centro ativo.
Sua estrutura quaternária foi determinada pela primeira vez para a proteína expressa em porcos através da técnica de cristalografia em raio x. O resultado foi semelhante ao exibido pela forma madura ou ativa da proteína, a pepsina.
Assim, a única diferença encontrada é a presença na pepsinogênio de um peptídeo de 44 aminoácidos que se dobra sobre a fenda do local ativo. Nesta posição, dificulta a interação dessa protease com as proteínas a serem degradadas.
Este peptídeo que será clivado para dar origem à enzima ativa, está localizado na extremidade terminal amino da proteína.
Como funciona apenas como um limite, a incapacidade da proteína de degradação pepsinogênio não se deve a deformações estruturais do centro ativo. Pelo contrário, isso permanece com a mesma conformação nas duas formas da enzima.
Pode atendê -lo: glucans: estrutura, características e funçõesNesse sentido, vale a pena notar que a estrutura cristalina do pepsinogênio constitui um modelo aproximado da estrutura de outros zimogenos pertencentes à grande família de proteínas aspárticas.
Funções
No início da vida, a pepsina (forma ativa de pepsinogênio) é importante para a digestão do leite. Posteriormente, sua função é degradar proteínas da dieta em seus constituintes (aminoácidos) para facilitar sua fácil absorção.
Síntese e secreção
A pepsinogênio é sintetizada pelas células principais e células finais da mucosa gástrica. Posteriormente, é armazenado em vesículas secretoras que permanecem no citoplasma dessas células até o momento em que sua liberação é necessária.
Portanto, a secreção deste zimogênio é um processo que é regulado. Sua liberação de vesículas, residentes de citosol por exocitose, requer estímulos hormonais e neurais. O aumento nos níveis de enzimas gástricas secretam e gastrina, bem como na acetilcolina, colecistoquinina, fator de crescimento epidérmico e óxido nítrico estimulam sua síntese e secreção.
Além disso, experimentos realizados com células ATT20, uma linha celular comumente usada no estudo de estradas de secreção em mamíferos, mostraram que um aumento no amplificador cíclico também é capaz de induzir essa secreção.
Além de sua secreção normal no nível do estômago, uma quantidade relativamente baixa de pepsinogênio foi detectada no sangue e na urina, e é por isso que foi chamada de uropepsinogênio.
A origem do uropepsinogênio, bem como a função que ele pode desempenhar em ambos os locais, permanece sem ser determinado. No entanto, sua ausência em pacientes que removeram totalmente o estômago parece indicar que sua origem é igualmente estômago.
Pessoal
Dois tipos principais de pepsinogênio foram descritos até agora: Pepsinogênio I e Pepsinogênio II. Ambos os tipos não apresentam diferenças em sua atividade catalítica e são igualmente ativados pela hidrólise proteolítica dependente do ácido clorídrico.
Pode atendê -lo: desnaturação de proteínas: o que é, fatores, consequênciasPepsinogênio I é sintetizado e segregado pelas células principais e pelas células finais da mucosa gástrica. Portanto, sua secreção diminui em pacientes com gastrite crônica atrófica, uma doença estomacal caracterizada pelo desaparecimento total das glândulas gástricas.
Ao contrário do último, a Pepsinogênio II (PGII) é sintetizada por praticamente todas as células que fazem parte da mucosa gástrica, mas com mais destaque pelas da mucosa antral e aquelas que compõem as glândulas Brünner presentes no duodeno.
Em pacientes com gastrite crônica atrófica, esse tipo de pepsinogênio compensa a diminuição da secreção de pepsinogênio I.
A existência desses dois tipos de pepsinogênio, que difere apenas por ser secretada por diferentes células, pode parecer redundante. No entanto, pode ser uma adaptação evolutiva para garantir a síntese de pepsina sempre que necessário.
Ativação
Pepsinogênio adquire atividade catalítica quando transformada em pepsina, produto da eliminação do peptídeo de 44 aminoácidos presente na cavidade do local ativo.
Sua operação ideal depende dos baixos valores de pH incluídos na faixa de 1,5 a 2. Em condições fisiológicas, esses valores são mantidos pela secreção de ácido hidroclorico em canais intracelulares.
A digestão ácida no nível do estômago não ocorre em todos os animais, sendo um exemplo disso, são insetos, que não têm pepsinogênio. No entanto, vertebrados que têm estômago se tiverem atividade péptica.
Pepsinogênio, que é armazenado nas vesículas secretoras das células principais, é liberado no ducto gástrico quando necessário. Quando atinge o estômago, torna -se pepsina o produto do ambiente ácido e este ativo mais moléculas pepsinogênicas.
Por ação de fibras nervosas intrínsecas e estimulação extrínseca vagal, a produção de pepsinogênio é estimulada, bem como HCl, gastrina e histamina. Por outro lado, a histamina e a gastrina estimulam as células parietais a secretar HCl.
Pode servir a você: tecidos condutores: o que é, características, funçõesPepsina, como toda endopeptidase, atua em vínculos específicos entre aminoácidos de proteínas para gerar peptídeos menores.
Em outras palavras; Hidrolisa as ligações peptídicas internas de uma proteína. Sua ação é mais eficaz em ligações peptídicas próximas a aminoácidos aromáticos (fenilalanina, tirosina). Ao contrário de seu precursor zimogênio, as mudanças adaptativas da pepsina nos valores de pH maiores que 6 produzem declínios irreversíveis de atividade catalítica.
Referências
- Bryksa BC, Tanaka T, Yada RY. A modificação N-terminal aumenta a estabilidade neutra-ph de pepsina. Bioquímica. 2003; 42: 13331-13338.
- Foltmann B, Pedreson VB. Comparação das estruturas primárias da protesa ácida e de seus zimogênios. ADV EXP MED BIOL. 1977; 95: 3-22.
- Guyton A, Hall J. (2006). Livro de Fisiologia Médica. (11ª ed.). EUA: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S, Jameson J. (2005). Harrison, Princípios de Medicina Interna. (16ª ed.). México: McGrawhill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino MA. Gastrite atrófica grave com infecção por helicobacter pylori e câncer gástrico. Câncer de intestino. 1998; 1: 118-124.
- Lin Y, encontrado M, Lin X, Hartsuck JA, Tang J. Dependência do pH dos parâmetros cinéticos da pepsina, rhizopuspepsina e seus mutantes de ligações de hidrogênio no local ativo. J Biol Chem. 1992; 267: 18413-18418.
- Mangeat p. Secreção ácida e reorganização de membrana em uma única célula parietal gástrica na cultura primária. Célula de biologia. 1990; 69: 223-257.
- Prozialeck J, Wershil BK. (2017). Desenvolvimento da função secretora gástrica. Fisiologia fetal e neonatal (quinta edição). Volume 1, páginas 881-888.
- Schubert Ml. Segredo gástrico. Opin atual Gastroent 2005; 21: 633-757.
- Sielecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James Mng. As estruturas moleculares e cristalinas da pepsina porcina monoclínica refinadas em 1.8 Å Resolução. J Mol Biol. 1990; 214: 143-170.
- Webb PM, Hengels KJ, Moller H, Newell DG, Palli D, Elder JB. A epidemiologia de baixos níveis séricos de pepsinogênio A e uma associação internacional com taxas de câncer gástrico. Gastroenterologia. 1994; 107: 1335-1344.
- Wolfe mm, Soll ah. A fisiologia do segredo do ácido gástrico. N English J Med 1998; 319: 1707.
- « G Cells Desenvolvimento, Gastrina, Canais de Tripíciliza de Peatle
- Características de Nanche, habitat, propriedades, receitas de cozinha »

