Propriedades de oxigênio, estrutura, riscos, usos

- 3384
- 370
- Tim Mann
Ele oxigênio É um elemento químico que é representado pelo símbolo ou. É um gás muito reativo, que chega o grupo 16: os calcógenos. Este nome é porque o enxofre e o oxigênio estão presentes em quase todos os minerais.
Sua alta eletronegatividade explica sua grande avidez pelos elétrons, o que leva à combinação com um alto número de elementos; É assim que surge uma grande variedade de óxidos minerais que enriquecem a crosta terrestre. Assim, o oxigênio restante compõe e torna a atmosfera respirável.
 O oxigênio é geralmente sinônimo de ar e água, mas também é encontrado em rochas e minerais. Fonte: pxhere.
O oxigênio é geralmente sinônimo de ar e água, mas também é encontrado em rochas e minerais. Fonte: pxhere. O oxigênio é o terceiro elemento em abundância no universo, atrás de hidrogênio e hélio, e também é o principal constituinte de massa do córtex da Terra. Possui uma porcentagem de volume de 20,8% da atmosfera da Terra e representa 89% da massa de água.
Geralmente tem duas formas alotrópicas: oxigênio diatômico (ou2), que é a maneira mais frequente da natureza e ozônio (ou3), encontrado na estratosfera. No entanto, existem outros dois (ou4 EU8) que existem em suas fases líquidas ou sólidas e sob enormes pressões.
O oxigênio é constantemente produzido através do processo de fotossíntese, realizado por fitoplâncton e plantas terrestres. Uma vez produzido, é lançado para que os seres vivos possam usá -lo, enquanto uma pequena porção se dissolve nos mares, apoiando a vida aquática.
É, portanto, um elemento essencial para os seres vivos; Não apenas porque está presente na maioria dos compostos e moléculas que os formam, mas também intervêm em todos os seus processos metabólicos.
Embora controversa seu isolamento seja atribuído a Carl Scheele e Joseph Priestley em 1774, há indicações de que o oxigênio foi realmente isolado pela primeira vez em 1608, por Michael Sendivogius.
Este gás é usado na prática médica para melhorar as condições de vida dos pacientes com dificuldades respiratórias. Da mesma forma, o oxigênio é usado para permitir que as pessoas cumpram suas funções em ambientes em que há diminuição ou nenhum acesso ao oxigênio atmosférico.
O oxigênio produzido comercialmente é usado principalmente na indústria metalúrgica para conversão de ferro em aço.
[TOC]
História
Espírito Nitroarial
Em 1500, Leonardo da Vinci, com base nos experimentos de Philo de Byzantium realizados no segundo século para. C., Ele concluiu que uma parte do ar foi consumida durante a combustão e respiração.
Em 1608, Cornelius Drebble mostrou que a sala de aquecimento (nitrato de prata, KNO3) Ocorreu um gás. Esse gás, como seria conhecido mais tarde, era oxigênio; Mas Drebble não conseguiu identificá -lo como um novo elemento.
Então, em 1668, John Magow apontou que uma parte do ar que ele chamou de "Spiritus nitroaerus" era responsável pelo fogo e que também foi consumido durante a respiração e a combustão de substâncias. Magow observou que as substâncias não organizaram na ausência do espírito nitroarial.
Majoow realizou a combustão antimônio e observou um aumento no peso do antimônio durante sua combustão. Então, Magow concluiu que o antimônio combinado com o espírito nitroarial.
Descoberta
Embora ele não tenha recebido reconhecimento da comunidade científica, na vida ou após sua morte, Michael Sandivogius (1604) provavelmente será o verdadeiro descobridor de oxigênio.
Sandivogius era um alquimista, filósofo e médico sueco que produziu a decomposição térmica de nitrato de potássio. Seus experimentos o levaram à libertação de oxigênio, que ele chamou de "Cibus Vitae": Food of Life.
Entre 1771 e 1772, o químico sueco Carl W Scheele aqueceu vários compostos: nitrato de potássio, óxido de manganês e óxido de mercúrio. Scheele observou que um gás que aumentou a combustão foi liberado deles e para o qual ele chamou de "ar de fogo".
Joseph Priestly Experiments
Em 1774, o químico inglês Joseph aqueceu sacerdotal que aqueceu o óxido de mercúrio usando uma lente de doze polegadas que aumenta a luz solar. O óxido de mercúrio liberou um gás que fez a vela queimar muito mais rápido que o normal.
Além disso, testou sacerdotal o efeito biológico do gás. Para fazer isso, ele colocou em um recipiente fechado um mouse que esperava sobreviver a quinze minutos; No entanto, na presença de gás, ele sobreviveu a uma hora, mais do que estimou.
Priestly publicou seus resultados em 1774; Enquanto Scheele fez isso em 1775. Por esse motivo, a descoberta de oxigênio para sacerdotal é geralmente atribuída.
Oxigênio no ar
Antoine Lavoisier, um químico francês (1777), descobriu que o ar contém 20% de oxigênio e que quando uma substância queima, ele está realmente combinando com oxigênio.
Lavoisier concluiu que o aparente ganho de peso que as substâncias experimentadas durante a combustão ocorreu devido à perda de peso que ocorre no ar; Como o oxigênio combinado com essas substâncias e, portanto, as massas dos reagentes foram preservadas.
Isso permitiu que Lavoisier estabelecesse a Lei da Conservação da Matéria. Lavoisier sugeriu o nome de oxigênio que veio da raiz "oxys" ácido e "genes" formação. Então oxigênio significa 'ácido anterior'.
Esse nome está errado, pois nem todos os ácidos contêm oxigênio; Por exemplo, hidrogênio halogenogia (HF, HCl, HBR e HI).
Dalton (1810) atribuído à água a fórmula química Ho e, portanto, o peso atômico do oxigênio foi 8. Um grupo de produtos químicos, incluindo: Davy (1812) e Berzelius (1814) corrigiu a abordagem de Dalton e concluiu que a fórmula correta da água é h2O e o peso atômico do oxigênio é 16.
Pode atendê -lo: água desionizadaPropriedades físicas e químicas
Aparência
Gás incolor, vaso sanitário e sem gosto; Enquanto o ozônio tem um cheiro de hectare. Oxigênio favorece a combustão, mas por si só não é um combustível.
 Oxigênio líquido. Fonte: Sargento da equipe. Nika Glover, U.S. Força Aérea [domínio público]
Oxigênio líquido. Fonte: Sargento da equipe. Nika Glover, U.S. Força Aérea [domínio público] Na sua forma líquida (imagem superior), é azul pálido e seus cristais também são azulados; Mas eles podem adquirir tons rosa, laranja e até avermelhado (como será explicado na seção de sua estrutura).
Peso atômico
15.999 u.
Número atômico (Z)
8.
Ponto de fusão
-218.79 ºC.
Ponto de ebulição
-182.962 ºC.
Densidade
Em condições normais: 1.429 g/l. Oxigênio é um gás mais denso que o ar. Além disso, é um mau condutor de calor e eletricidade. E em seu ponto de ebulição (líquido), a densidade é de 1.141 g/ml.
Ponto Triplo
54.361 K e 0,1463 kPa (14,44 atm).
Ponto crítico
154.581 K e 5.043 MPa (49770,54 atm).
Calor de fusão
0,444 kJ/mol.
Calor de vaporização
6,82 kJ/mol.
Capacidade calórica molar
29.378 J/(mol · k).
Pressão de vapor
A uma temperatura de 90 K tem uma pressão de vapor de 986,92 atm.
Estados de oxidação
-2, -1, +1, +2. O status de oxidação mais importante é -2 (ou2-).
Eletro-negatividade
3.44 na escala Pauling
Energia de ionização
Primeiro: 1.313,9 KJ/mol.
Segundo: 3.388,3 KJ/mol.
Terceiro: 5.300,5 kJ/mol/mol.
Ordem magnética
Paramagnético.
Solubilidade em água
A solubilidade de oxigênio na água diminui à medida que a temperatura aumenta. Por exemplo: 14,6 ml de oxigênio/L de água é dissolvido a 0 ºC e 7,6 ml de oxigênio/L de água a 20 ºC. A solubilidade do oxigênio na água potável é maior do que na água do mar.
Na condição de temperatura 25 ºC e a uma pressão 101,3 kPa, a água potável pode conter 6,04 ml de oxigênio/L de água; Enquanto água da água do mar apenas 4,95 ml de oxigênio/L de água.
Reatividade
O oxigênio é um gás altamente reativo que reage diretamente com quase todos os elementos à temperatura ambiente e altas temperaturas; exceto para metais com maior potencial de redução do que o cobre.
Você também pode reagir com os compostos, oxidando os elementos presentes neles. É o que acontece quando reage com a glicose, por exemplo, para produzir água e dióxido de carbono; ou quando a madeira ou um hidrocarboneto queima.
O oxigênio pode aceitar elétrons por transferência completa ou parcial, por isso é considerado um agente oxidante.
O número de oxidação mais comum ou o status de oxidação é -2. Com este número de oxidação, é encontrado na água (h2O), dióxido de enxofre (então2) e dióxido de carbono (CO2).
Além disso, em compostos orgânicos, como aldeídos, álcoois, ácidos carboxílicos; ácidos comuns como H2SW4, H2Co3, Hno3; E em seus sais derivados: na2SW4, N / D2Co3 OK não3. Em todos eles, a existência do O poderia ser assumida2- (que não é verdadeiro para compostos orgânicos).
Óxidos
Oxigênio está presente como ou2- Nas estruturas cristalinas de óxidos metálicos.
Por outro lado, em superóxidos de metal, como superóxido de potássio (KO2), oxigênio é como íons ou2-. Enquanto em peróxidos de metal, para dizer peróxido de bário (BAO2), o oxigênio é apresentado como o íon ou22- (BA2+QUALQUER22-).
Isótopos
O oxigênio tem três isótopos estáveis: 16Ou, com 99,76% de abundância; ele 17Ou, com 0,04%; e ele 18Ou, com 0,20%. Observe que ele 16Ou é de longe o isótopo mais estável e abundante.
Estrutura e configuração eletrônica
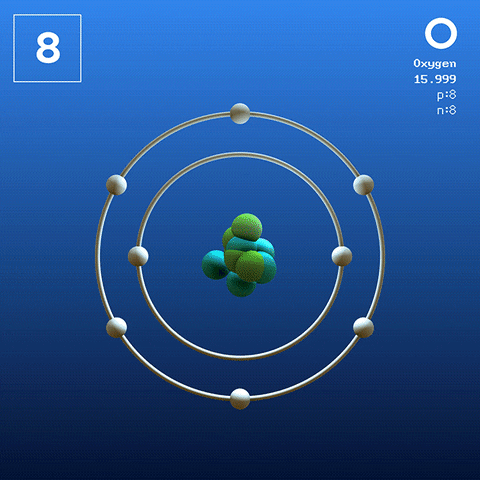
Molécula de oxigênio e interações
 Molécula de oxigênio diatômico. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Molécula de oxigênio diatômico. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] O oxigênio em seu estado basal é um átomo cuja configuração eletrônica é:
[Ele] 2s2 2 p4
De acordo com a teoria do vínculo de Valência (TEV), dois átomos de oxigênio são ligados covalentemente para que ambos completem separadamente seu octeto de Valencia; Além de poder acasalar seus dois elétrons solitários dos orbitais 2p.
Dessa forma, a molécula diatômica de oxigênio aparece, ou2 (Imagem mais alta), que tem uma ligação dupla (o = o). Sua estabilidade energética é tal que o oxigênio nunca é encontrado como átomos individuais na fase gasosa, mas como moléculas.
Porque o o2 Ele é homonuclear, linear e simétrico, carece de momento dipolar permanente; Portanto, suas interações intermoleculares dependem de sua massa molecular e das forças de dispersão de Londres. Essas forças são relativamente fracas para o oxigênio, o que explica por que é um gás em condições terrestres.
No entanto, quando a temperatura cai ou aumenta a pressão, moléculas ou2 Eles são forçados a coesos; a ponto de suas interações se tornarem significativas e permitir a formação de oxigênio líquido ou sólido. Para tentar entendê -los molecularmente, é necessário não perder de vista o O2 como unidade estrutural.
Ozônio
O oxigênio pode adotar outras estruturas moleculares consideravelmente estáveis; Isto é, é encontrado na natureza (ou dentro do laboratório) em várias formas alotrópicas. O ozônio (imagem inferior), ou3, Por exemplo, é a segunda alotrópia do oxigênio mais conhecido.
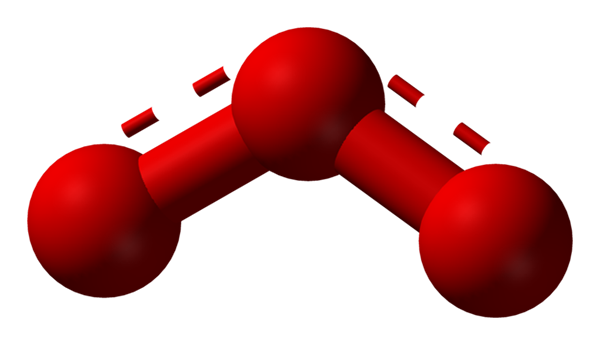 Estrutura do híbrido de ressonância representado por um modelo de esferas e barras para a molécula de ozônio. Fonte: Ben Mills via Wikipedia.
Estrutura do híbrido de ressonância representado por um modelo de esferas e barras para a molécula de ozônio. Fonte: Ben Mills via Wikipedia. Novamente, o Tev sustenta, explica e demonstra que no ou3 Deve haver estruturas de ressonância que estabilizam a carga formal positiva do oxigênio central (linhas pontilhadas em vermelho); Enquanto oxigênio do final do bumerangue uma carga negativa é distribuída, causando a carga total para o ozônio.
Pode atendê -lo: regras de solubilidade: aspectos e regras geraisDessa forma, os links não são simples, mas não duplos. Exemplos de híbridos de ressonância são muito comuns em tantas moléculas ou íons inorgânicos.
O o2 EU3, Como resultado de que suas estruturas moleculares são diferentes, o mesmo vale para suas propriedades físicas e químicas, fases líquidas ou cristalinas (mesmo que ambos consomam átomos de oxigênio). Eles teorizam essa síntese em grandes escalas de ozônio cíclico é provável, cuja estrutura se assemelha à de um triângulo avermelhado e oxigenado.
Até agora, os "amadores normais" de oxigênio chegam. No entanto, há outros dois a considerar: O4 EU8, encontrado ou proposto em oxigênio líquido e sólido, respectivamente.
Oxigênio líquido
O oxigênio gasoso é incolor, mas quando a temperatura desce para -183 ºC, condensa em um líquido azul pálido (celestial semelhante). Interações entre moléculas ou2 É agora que mesmo seus elétrons podem absorver fótons na região vermelha do espectro visível para refletir sua cor azul característica.
No entanto, tem sido teorizado que neste líquido existem mais do que moléculas simples ou2, mas também uma molécula ou4 (Imagem inferior). Parece que o ozônio "prendeu" outro átomo de oxigênio que de alguma forma intercede pela carga formal formal recém -descrita.
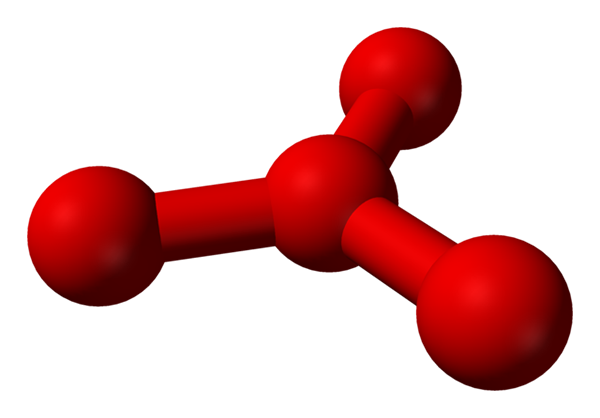 Modelo Estrutura proposta com esferas e barras para a molécula de tetraoxigênio. Fonte: Benjah-BMM27 [Domínio Público]
Modelo Estrutura proposta com esferas e barras para a molécula de tetraoxigênio. Fonte: Benjah-BMM27 [Domínio Público] O problema é que, de acordo com o computador e simulações moleculares, a referida estrutura para o O4 Não é precisamente estável; No entanto, eles prevêem que existem como unidades (ou2)2, isto é, duas moléculas de O2 Eles se aproximam tanto que formam um tipo de estrutura irregular (átomos ou não estão alinhados um com o outro).
Oxigênio sólido
Uma vez que a temperatura desce para -218,79 ºC, o oxigênio cristaliza em uma estrutura cúbica simples (fase γ). À medida que a temperatura cai ainda mais, o vidro cúbico sofre transições para as fases β (Rhomboédica e em -229,35 ºC) e α (monoclínico e -249,35 ºC).
Todas essas fases cristalinas de oxigênio sólido ocorrem a pressão ambiente (1 atm). Quando a pressão aumenta para 9 GPa (~ 9000 atm), a fase δ aparece, cujos cristais são laranja. Se a pressão continuar aumentando para 10 GPa, o oxigênio sólido vermelho aparecerá ou a fase ε (novamente monoclínica).
A fase ε é especial porque a pressão é tão grande que as moléculas ou2 Eles não são apenas acomodados como unidades ou4, mas também ou8:
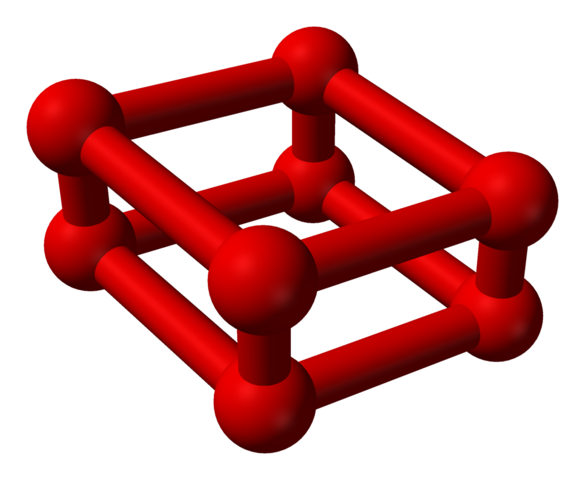 Estrutura do modelo com esferas e barras para molécula de octaoxigênio. Fonte: Benjah-BMM27 [Domínio Público]
Estrutura do modelo com esferas e barras para molécula de octaoxigênio. Fonte: Benjah-BMM27 [Domínio Público] Observe que isso ou8 Consiste em duas unidades ou4 onde a estrutura irregular já explicou. Também é válido considerá -lo quatro ou2 Alinhado e em posições verticais intimamente. No entanto, sua estabilidade está tão sob essa pressão que o ou4 EU8 São dois outros outros para oxigênio.
E, finalmente, temos a fase ζ, metálica (para pressões maiores que 96 GPa), na qual a pressão faz com que os elétrons se dispersem no vidro; Como nos metais.
Onde está e produção
Minerais
Oxigênio está em massa o terceiro elemento do universo, atrás de hidrogênio e hélio. Constitui o elemento mais abundante da crosta terrestre, representando cerca de 50% de sua massa. É combinado principalmente com silício, na forma de óxido de silício (Sio2).
Oxigênio está fazendo parte de inúmeros minerais. Da mesma forma, está localizado como parte de vários compostos, como carbonatos, fosfatos, sulfatos, nitratos, etc.
Ar
Oxigênio constitui 20,8% do ar atmosférico em volume. Na troposfera, é principalmente como uma molécula de oxigênio diatômica. Enquanto estava na estratosfera, uma camada gasosa entre 15 e 50 km da superfície da Terra é como ozônio.
Ozônio é produzido por um choque elétrico na molécula de O2. Esse alotrópio de oxigênio absorve a luz ultravioleta da radiação solar, bloqueando sua ação prejudicial aos seres humanos, que em casos extremos está associada ao aparecimento de melanomas.
Água fresca e salgada
Oxigênio é um componente principal da água do mar e água fresca de lagos, rios e água subterrânea. Oxigênio faz parte da fórmula química da água, massando 89%.
Por outro lado, embora a solubilidade do oxigênio na água seja relativamente baixa, a quantidade de oxigênio dissolvida nisso é essencial para a vida aquática, que inclui numerosas espécies de animais e algas.
Seres vivos
O ser humano é formado, aproximadamente 60% da água e, ao mesmo tempo, rico em oxigênio. Além disso, o oxigênio faz parte de numerosos compostos, como fosfatos, carbonatos, ácidos carboxílicos, cetonas, etc., que são essenciais para a vida.
O oxigênio também está presente em polissacarídeos, lipídios, proteínas e ácidos nucleicos; isto é, as macromoléculas biológicas de tão chamadas.
Também faz parte do desperdício prejudicial da atividade do homem, por exemplo: dióxido de carbono e dióxido, bem como dióxido de enxofre.
Produção biológica
 As plantas são responsáveis por enriquecer o ar de oxigênio em troca de dióxido de carbono que expiramos. Fonte: pexels.
As plantas são responsáveis por enriquecer o ar de oxigênio em troca de dióxido de carbono que expiramos. Fonte: pexels. O oxigênio ocorre durante a fotossíntese, um processo pelo qual fitoplâncton marinho e plantas terrestres usam energia luminosa para reagir dióxido de carbono com água, causando glicose e liberando oxigênio.
Estima -se que mais de 55% do oxigênio produzido pela fotossíntese seja devido à ação do fitoplâncton marinho. Portanto, constitui a principal fonte de geração de oxigênio na Terra e é responsável pela manutenção da vida nela.
Produção industrial
Liquefação do ar
O principal método de produção industrial de oxigênio é criado em 1895, independentemente por Karl Paul Gottfried von Linde e William Hamson. Este método está atualmente usando algumas modificações.
Pode atendê -lo: butanona: estrutura, propriedades e usosO processo começa com a compressão do ar para condensar o vapor de água e, assim, eliminá -lo. Então, o ar é peneirado quando conduzido por uma mistura de zeólito e sílica gel, para a eliminação de dióxido de carbono, hidrocarbonetos pesados e o restante da água.
Posteriormente, os componentes do ar líquido são separados através de uma destilação fracionada, alcançando a separação dos gases presentes em seus diferentes pontos de ebulição. Por esse método, o oxigênio é obtido com 99% de pureza.
Eletrólise aquática
O oxigênio é produzido por eletrólise de água altamente purificada e com condutividade elétrica que não excede 1 µs/cm. A água é separada por eletrólise em seus componentes. Hidrogênio como cátion se move para o cátodo (-); Enquanto o oxigênio se move em direção ao ânodo (+).
Os eletrodos têm uma estrutura especial para coletar os gases e, posteriormente, produzem sua liquefação.
Decomposição termal
A decomposição térmica de compostos como óxido de mercúrio e hospedeiro (nitrato de potássio) libera oxigênio, que pode ser coletado para uso. Peróxidos também são usados para esse fim.
Artigo biológico
O oxigênio é produzido pelo fitoplâncton e plantas terrestres através da fotossíntese. Ele atravessa a parede pulmonar e, no sangue, é capturado pela hemoglobina, que o transporta para diferentes órgãos e depois usado no metabolismo celular.
Nesse processo, o oxigênio é usado durante o metabolismo de carboidratos, ácidos graxos e aminoácidos, para finalmente produzir dióxido de carbono e energia.
A respiração pode esquematizar o seguinte:
C6H12QUALQUER6 + QUALQUER2 => Co2 + H2Ou +energia
A glicose é metabolizada em um conjunto de processos químicos seqüenciais, que inclui glicólise, o ciclo Krebs, a cadeia de transporte eletrônico e a fosforilação oxidativa. Esta série de eventos produz energia que se acumula como ATP (Adenosín Triposfato).
O ATP é usado em vários processos em células que incluem o transporte de íons e outras substâncias através da membrana plasmática; a absorção intestinal de substâncias; a contração de diferentes células musculares; O metabolismo de diferentes moléculas, etc.
Os leucócitos polimorfonucleares e macrófagos são células fagocíticas capazes de usar oxigênio para produzir íon superóxido, peróxido de hidrogênio e oxigênio único, que são usados para destruir microorganismos.
Riscos
O oxigênio respiratório para altas pressões pode causar náusea, tontura, espasmos musculares, perda de visão, convulsões e perda de consciência. Além disso, respirar oxigênio puro por um longo período de tempo causa irritação pulmonar, manifestada pela tosse e um encurtamento da respiração.
Também pode ser a causa da formação de um edema pulmonar: uma condição muito séria que limita a função respiratória.
Uma atmosfera com alta concentração de oxigênio pode ser perigosa, pois facilita o desenvolvimento de incêndios e explosões.
Formulários
Médicos
O oxigênio é administrado a pacientes com insuficiência respiratória; É o caso dos pacientes afetados por pneumonia, edema pulmonar ou enfisema. Eles não podiam respirar oxigênio ambiental, pois seriam seriamente afetados.
Pacientes com insuficiência cardíaca no que é apresentado acúmulo líquido em alvéolos também precisam de oxigênio a ser fornecido; Como pacientes que sofreram um acidente vascular grave (derrame).
Necessidade ocupacional
Os bombeiros que estão lutando contra um incêndio em um ambiente com ventilação inadequada, exigem o uso de máscaras e garrafa de oxigênio que lhes permitam cumprir suas funções, sem colocar suas vidas em maiores riscos.
Os submarinos estão equipados com equipamentos de produção de oxigênio que permitem que os marinheiros permaneçam em um ambiente fechado sem acesso ao ar atmosférico.
Os mergulhadores fazem seu trabalho submerso na água e, portanto, isolados do ar atmosférico. Eles respiram por oxigênio bombeados por tubos conectados à sua varredura ou o uso de bombonas presas ao corpo do submarino.
Os astronautas realizam suas atividades em ambientes equipados com geradores de oxigênio que permitem a sobrevivência durante viagens espaciais e em uma estação espacial.
Industrial
Mais de 50% do oxigênio produzido industrialmente é consumido na transformação de ferro em aço. O ferro fundido é injetado com um jato de oxigênio para eliminar o enxofre e o carbono presente; reaja para produzir SO gases2 e companhia2, respectivamente.
O acetileno é usado em combinação com oxigênio para cortar placas de metal e também para produzir sua soldagem. O oxigênio também é usado na produção de vidro, aumentando a combustão em seu cozimento para melhorar sua transparência.
Espectrofotometria de absorção atômica
A combinação de acetileno e oxigênio é usada para queimar amostras de diferentes origens em um espectrofotômetro de absorção atômica.
Durante o procedimento, um feixe de luz de uma lâmpada é influenciado pela chama, que é específica do elemento desejado para quantificar. A chama absorve a luz da lâmpada, permitindo a quantificação do elemento.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Oxigênio. Recuperado de: em.Wikipedia.org
- Richard Van Noordden. (13 de setembro de 2006). Apenas uma fase bonita? Oxigênio vermelho sólido: inútil, mas delicioso. Recuperado de: natureza.com
- Azonano. (4 de dezembro de 2006). Fase de cristal em fase eletrônica de oxigênio sólido determinado ao longo das descobertas de um cluster de oxigênio o8. Recuperado de: Azonano.com
- Centro Nacional de Informações sobre Biotecnologia. (2019). Molécula de oxigênio. Banco de dados PubChem. CID = 977. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Dr. Doug Stewart. (2019). Fatos do elemento de oxigênio. Chemicool. Recuperado de: Chemicool.com
- Robert c. Brasado. (9 de julho de 2019). Oxigênio: elemento químico. Encyclopædia britannica. Recuperado de: Britannica.com
- Crianças wiki. (2019). Família de oxigênio: propriedades de VIA elementos. Recuperado de: simplesmente.Ciência
- Advameg, inc. (2019). Oxigênio. Recuperado de: feito.com
- Lentech b.V. (2019). Tabela de período: oxigênio. Recuperado de: lentech.com
- Departamento de Saúde de Nova Jersey e Serviços Sênior. (2007). Oxigênio: folha de fato de substância perigosa. [PDF]. Recuperado de: NJ.Gov
- Yamel Mattarollo. (26 de agosto de 2015). Aplicações industriais industriais de oxigênio. Recuperado de: Altecdust.com
- « História de neon, propriedades, estrutura, riscos, usa
- Características da histidina, estrutura, funções, alimentos »

