Características da histidina, estrutura, funções, alimentos
- 2639
- 525
- Melvin Mueller
O Histidina (His, h) É um aminoácido que é usado para a síntese de proteínas. É uma molécula hidrofílica, por isso geralmente é orientada para o exterior das estruturas de proteínas quando estão em um meio líquido.
É considerado um aminoácido essencial para o crescimento de crianças, pois elas não o produzem. No adulto, há uma pequena produção de histidina, mas é insuficiente fornecer os requisitos diários, para que seja considerado um aminoácido semi -essencial.
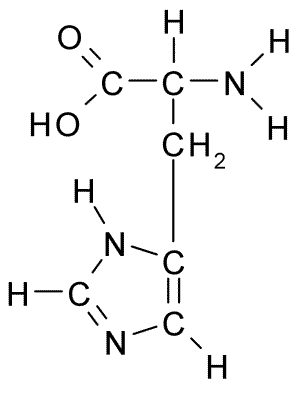
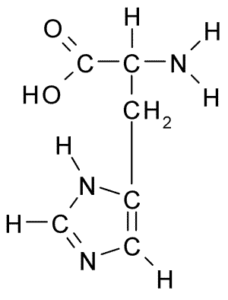 Estrutura química do aminoácido histidina (fonte: Borb, via Wikimedia Commons)
Estrutura química do aminoácido histidina (fonte: Borb, via Wikimedia Commons) Para animais e homem, a histidina é um aminoácido essencial ou pelo menos semi -essencial, no entanto, plantas, fungos e microorganismos produzem com eficiência a histidina de que precisam e fazem parte das fontes alimentares de histidina, além de proteínas animais animais.
A histidina cumpre funções fisiológicas muito importantes no ser humano, como: aquelas de fazer parte dos centros ativos de muitas enzimas, participando do crescimento, no sistema imunológico e na formação de mielina nas fibras nervosas, entre outros.
A biossíntese de histidina é um processo complexo que ocorre principalmente no fígado e requer 9 a 11 etapas enzimáticas. Sua degradação ocorre no fígado e na pele e passa pela formação de glutamato e seguindo caminhos diferentes.
Muitos alimentos são ricos em histidina, como proteínas animais, como carne e laticínios, bem como proteínas vegetais. Eles fornecem grande parte dos requisitos diários de histidina que nosso corpo precisa para funcionar corretamente.
O déficit ou excesso de histidina causado pelo herdador de problemas metabólicos ou de transporte, ou insuficiência alimentar na ingestão, estão relacionados a alguns problemas importantes que afetam a saúde, tanto em crianças quanto para adultos. O consumo suficiente de histidina permite que você mantenha uma vida saudável e saudável na maioria dos casos.
[TOC]
Caracteristicas
Uma característica de destaque da histidina é que ela pode ser convertida em histamina, uma substância que participa ativamente de muitas reações alérgicas e inflamatórias.
Nos peixes expostos ao meio ambiente sem refrigeração suficiente, as bactérias podem converter histidina em histamina e é por isso que, quando ingerido, causam intoxicação alimentar.
Outra característica desse aminoácido é que ele é um dos poucos, entre os 22 existentes, que na faixa de pH fisiológico (cerca de 7.4) É ionizado e, portanto, pode participar ativamente do local catalítico de muitas enzimas.
Na molécula de hemoglobina, a histidina proximal é um dos ligantes do grupo Hemo. Em outras palavras, esse aminoácido participa da função de transporte de oxigênio da hemoglobina e é indispensável para a síntese dessa proteína, bem como para a mioglobina, que também é conhecida como "hemoglobina muscular".
Estrutura
Histidina é um aminoácido Hidrofílico polar essencial, classificado em aminoácidos essenciais, pois não pode ser sintetizado por animais. No entanto, e como mencionado anteriormente, é sintetizado por bactérias, fungos e plantas.
Em crianças em crescimento, a histidina é absolutamente necessária; O adulto pode sintetizá -lo, mas não está claro se isso abrange as necessidades diárias da histidina, por isso deve ser ingerido com a dieta.
Como todos os aminoácidos, a histidina possui um carbono α para o qual um grupo amino, um grupo carboxila, um átomo de hidrogênio e uma cadeia lateral é unida.
Pode servir você: Coxiella BurnetiiA cadeia lateral deste aminoácido é formada por um anel de imidazol que, para pH fisiológico, prótons e adquire carga positiva e é chamada "Imidazolio " abreviado como IMH+.
Juntamente com lisina e arginina, a histidina forma o grupo de aminoácidos básicos. Dos três, a histidina é a menos básica e seu anel imididoólica pode ser desprotegido para o pH próximo a 6.
Como o pH fisiológico da histidina pode trocar prótons, isso geralmente participa de catálise enzimática que envolve a transferência de prótons. Além disso, como é um aminoácido polar, geralmente é encontrado na superfície externa das proteínas, onde pode hidratar em um meio aquoso.
Funções
Como parte do site da enzima ativa
A histidina é necessária para a síntese de muitas proteínas, especialmente enzimas cujos centros ativos têm esse aminoácido. Faz parte do centro ativo das aldlasases de mamíferos, onde funciona como doador de prótons.
Está localizado no centro ativo da carboxipeptidase A, uma enzima pancreática que possui um local ativo formado por Zn e Histidina. Na enzima glicolítica fosfogliceracia, existem dois resíduos de histidina em seu centro ativo que atuam como aceitadores ou doadores de grupos de fosforil.
Também é encontrado no local ativo de enzimas como gliceraldeído 3-fosfato desidrogenase, lactato desidrogenase, papaína, quimotripsina, rnasa a e amônia liasa histidina (histidase). Além disso, é um inibidor da enzima glutamina sintetase.
Outras funções
Este aminoácido é de grande importância para o organismo, uma vez que sua descarboxilase histidina decans.
A histidina é produzida por neurônios do sistema nervoso central com funções neuromoduladoras.
É necessário para a formação de vagens de mielina de fibras nervosas, por isso atende a um papel importante na transmissão de impulsos elétricos nelas.
Juntamente com o hormônio do crescimento e outros aminoácidos, a histidina contribui para os mecanismos de reparo de tecidos, principalmente no sistema cardiovascular.
Algumas funções adicionais incluem:
- Contribui com a desintoxicação de alguns metais pesados, uma vez que age como quelação.
- Protege contra danos causados por radiação.
- Participe da formação de glóbulos vermelhos e brancos.
- É necessário para a formação de hemoglobina.
- Ajuda a combater alguns efeitos negativos da artrite reumatóide, como inflamação e falta de mobilidade.
- É um aminoácido importante para a regeneração capilar, crescimento e função sexual.
A carnosina, anserina e homocosina, são dipéptides formados a partir de histidina. Os dois primeiros são encontrados nos músculos e têm funções importantes, como tampons e como ativadores da miosina Atasa.
A homocosina é produzida no cérebro em quantidades 100 vezes maiores que a carnuda do músculo esquelético.
Biossíntese
A histidina obtém seu esqueleto carbonatado da ribose de 5 fosfato. Nas bactérias E. Coli, Este aminoácido ocorre a partir do referido composto por meio de 11 etapas enzimáticas:
- A primeira etapa da síntese consiste na transferência de um fosforribosil de ATP para o carbono 1 da ribose de 5-fosfato, gerando 5-fosforribosil-1-pirofosfato (PRPP) (PRPP). A enzima firribosil-pirofosfato sintetase (Prpp sintetase) catalisa essa reação.
- Em seguida, a transferência do grupo pirofosfato de carbono 1 para o N-1 do ATP ocorre, e o N1- ocorre (5'-fosforribosil) -ATP. A enzima que catalisa essa reação é a ATP fosforeseltransferase.
- Pela ação da fosforribosil-top-pirofosfato hidroxilase, a ligação α, β-piofosfato da ATP é hidroxilase e o N1- é formado (5'-fosforribosil) -amp.
- A enzima fosforribosil-mapa hidroxilase abre o anel de purina entre o N-1 e o C-6 e o ribonucleotídeo é formado N1- (5'-fosforribosil formimino) -5-aminoimidazol-4-carboxamida-1-lribonucleotide.
- Em seguida, o anel ribofuranosa que vem do PRPP é aberto e é isomerizado para uma cetosa, formando o N1- (5'-fosforribosil formimina) -5-aminoimidazol-4-carboxamida-1-lribonucleotídeo por efeito de uma enzima isomerase.
- A enzima aminotransferase transfere o grupo de glutamina, que se torna glutamato, e quebra o link da formimina, por isso é liberado 5-aminoimidazol-carboxamida-1-lribonucleotídeo e o fosfato de imidazol-glicerol é gerado.
- Uma molécula de água do fosfato de imidazol-glicerol é eliminada por meio do fosfato de imidazol-glicerol desidratase e forma fosfato de imidazol-acetol.
- O fosfato de imidazol-acetol é transferido um grupo amino através de fosfato de histidinol transaminase e o fosfato histidinol é formado.
- O grupo éster fosfórico de histidinol fosfato para formar histidinol é hidrolisado. Fosfato de histidinol A fospatase catalisa essa reação.
- Posteriormente, o histidinol é oxidado pela histidinol desidrogenase e é histidinal.
- A mesma histidinol desidrogenase oxidam no histidinal e a torna histidina.
A primeira enzima da via biossintética da histidina é inibida pelo produto da rota, ou seja, a histidina participa da inibição alestric da fosforribosiltransferase ATP, que representa o principal mecanismo de regulação da rota.
Degradação
Histidina, prolina, glutamato, arginina e glutamina são aminoácidos que, quando acabam formando α-zotoglues. Quatro deles se tornam glutamato, que devido à transaminação dá origem a α-cetoglutores.
Histidina, através da histidinase, perde o grupo α-amino para se tornar Urocanato. Em seguida, a urocanase hidrata as posições 1 e 4 do urocanato, formando a 4-midazolona-5-propionato. Posteriormente, ocorre o grupo imino da 4-midazolona-5-propionato, formando o n-formiminoglutamato.
A última reação implica a transferência do formil do N-formiminoglutamato para o tetra-hidrofolato, que funciona com a transferência formiminosa da enzima glutamato. Os produtos finais desta reação são glutamato e N5-formimino tetra-hidrofolato.
Α-cetoglutarato é formado por transaminação de glutamato. O α-cetoglutarato é um intermediário do ciclo Krebs e também pode entrar na via gluconeogênica para formação de glicose.
O Grupo de Amino Glutamato entra no ciclo de produção de uréia a ser eliminado pela urina. Todas essas reações ocorrem no fígado e parte deles na pele.
Alimentos ricos em histidina
As necessidades diárias de histidina são de aproximadamente 10 a 11 mg por kg de peso corporal, por dia. Em crianças em crescimento, a histidina é um aminoácido essencial que deve ser fornecido com a dieta.
Em outros animais, a histidina também é um aminoácido essencial e aqueles que são criados em estábulos devem receber histidina para manter seus níveis normais de hemoglobina.
Entre os alimentos ricos em histidina estão:
- Carne, cordeiro, carne de porco, frango e peru. Também é encontrado em peixes como atum (mesmo em enlatados), salmão, truta, pargo e lubina, bem como em alguns frutos do mar.
Pode atendê -lo: cultura sanguínea: para que serve, fundamento, procedimento, resultados- Leite e seus derivados, especialmente em queijos amadurecidos como parmesão, Gruyere, queijo suíço, gouda, entre outros. Nos nativos, no soro, no iogurte e no creme de leite.
- Soja e nozes, como nozes e sementes. Em girassol, abóbora, melancia, gergelim, amêndoas, pistache, manteiga de amendoim e chia.
- Ovos e feijão ou feijão branco.
- Grãos integrais, como quinoa, trigo, arroz integral, etc.
Benefícios da sua ingestão
Existem várias condições patológicas nas quais a histidina pode ser útil como adjuvante para tratamento.
Entre essas patologias, podemos nomear a artrite reumatóide, hipertensão arterial (uma vez que um efeito hipotensivo da histidina foi descrito), em infecções, frigidez e sexo e audição, úlceras e anemias.
Na pele, a degradação da histidina consumida produz ácido urocânico, capaz de proteger a pele, pois absorve raios ultravioleta.
O excesso de consumo por indivíduos saudáveis não produz alterações importantes, pois é rapidamente degradado. No entanto, o uso de suplementos dietéticos da histidina naqueles pacientes com fígado grave e/ou problemas renais deve ser restrito.
Distúrbios de deficiência
O déficit de histidina está relacionado a alterações na resposta imune devido.
Problemas ósseos, surdez e anemias associados ao déficit de histidina também foram relatados.
A doença de Hartnup é uma condição hereditária que afeta o transporte de histidina e triptofano através da mucosa do intestino fino e dos rins, o que causa um déficit de ambos os aminoácidos.
As manifestações clínicas mais relevantes são o aparecimento de lesões esguios e vermelhas na pele após a exposição ao sol, vários graus de alteração do movimento e alguns sintomas de doenças psiquiátricas.
A histidinemia é uma doença recessiva autossômica que é caracterizada pelo déficit da enzima histidase, que causa um aumento nas concentrações de histidina no sangue e na urina.
Como conseqüência, esses pacientes não podem degradar a histidina para o ácido urocal no fígado e na pele. Esta doença é acompanhada por retardo mental moderado, defeitos de fala e memória auditiva sem surdez.
A restrição da ingestão de histidina como tratamento não tem sido eficaz na geração de melhora clínica e implica o risco de gerar distúrbios de crescimento em crianças afetadas por esta doença.
Referências
- Mathews, c., Van holde, k., & Ahern, k. (2000). Bioquímica (3ª ed.). São Francisco, Califórnia: Pearson.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, P. (2009). Bioquímica ilustrada de Harper (28ª ed.). McGraw-Hill Medical.
- Nelson, d. eu., & Cox, M. M. (2009). Lehninger Principles of Biochemistry. Edições Omega (5ª ed.). doi.org
- Perecarz, p., Farri, l., & Papageorgiou, um. (1983). Os efeitos do leite humano e das fórmulas de baixa proteína nas taxas de mudança total de proteínas corporais e excreção urinária de 3-metilhistidina de bebês prematuros. Ciência Clínica, 64, 611-616.
- Música, b. C., Joo, n., Aldini, g., & Yeum, k. (2014). Função biológica de histidina-dipeptídeos e síndrome metabólica. Pesquisa e prática nutricional, 8(1), 3-10.
- « Propriedades de oxigênio, estrutura, riscos, usos
- História de sistemas especializados, características, vantagens, desvantagens »

