Estrutura de oxalato de sódio (Na2C2O4), propriedades, usos, riscos

- 2127
- 463
- Shawn Leffler
Ele oxalato de sódio É um composto orgânico formado por dois íons de sódio e um íons de oxalato. Sua fórmula química é na2C2QUALQUER4 ou também na2(COO)2. É o sal de sódio de ácido oxálico ou ácido etanodióico. Então uma2C2QUALQUER4 É um sólido branco cristalino e suas soluções aquosas são básicas (alcalinas).
Oxalato de sódio está presente em plantas e vegetais. No ser humano, ele é gerado naturalmente a partir de seu ácido oxálico conjugado, que por sua vez é produzido por certos processos metabólicos.
 Oxalato de sódio na2(COO)2 sólido. Lem [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Oxalato de sódio na2(COO)2 sólido. Lem [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Então uma2C2QUALQUER4 É usado em laboratórios de análise química como um agente redutor (o oposto do oxidante). Também para permitir testes para certos compostos orgânicos durante o tratamento de águas residuais.
Foi usado para a eliminação de resíduos de clorofluorocarbonetos (CGC), que danifica a camada de ozônio. Também é matéria -prima para obter ácido oxálico de maneira econômica.
Devido ao alto teor de oxalato de sódio de alguns vegetais comestíveis, as pessoas que tendem a formar cálculos ou pedras nos rins devem evitar consumir esses alimentos. Isso ocorre porque as pedras são geralmente formadas com oxalatos.
[TOC]
Estrutura
O oxalato de sódio é composto de dois cátions de Sodium Na+ e um ânion de oxalato (COO)22-. O ânion oxalato é formado por sua vez por dois COO- juntou -se aos dois átomos de carbono: -Ooc-coo-.
Em oxalato de sódio sólido, o ânion oxalato tem uma forma plana. Isso significa que carbonos e oxigênio são encontrados no mesmo avião.
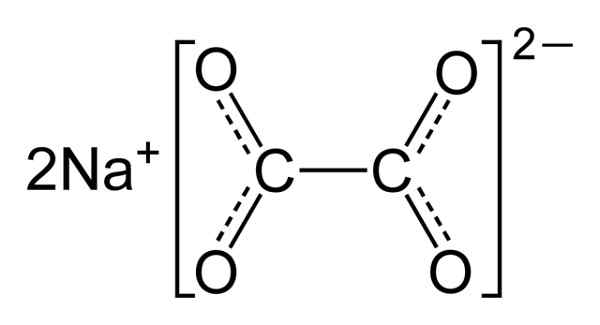 Estrutura química de oxalato de sódio2(COO)2. Autor: Benjah-BMM27. Fonte: Wikimedia Commons.
Estrutura química de oxalato de sódio2(COO)2. Autor: Benjah-BMM27. Fonte: Wikimedia Commons. Nomenclatura
- Oxalato de sódio
- Disodio oxalato
- Sal de sódio de ácido etanodióico
Propriedades
Estado físico
Sólido branco cristalino.
Peso molecular
134,0 g/mol
Densidade
2,27 g/cm3 A 20 ° C.
Solubilidade
Solúvel em água: 3,7 g/100 ml a 20 ° C.
ph
Suas soluções aquosas são básicas (alcalinas) porque o ânion oxalato tende a levar os prótons de água que deixam os íons oh grátis-.
Pode atendê -lo: neon: história, propriedades, estrutura, riscos, usosPropriedades quimicas
Pode neutralizar ácidos e reações são exotérmicas, ou seja, eles emitem calor.
Serve como um agente redutor e, nessas reações, gera um dióxido de carbono Co2.
Tem a propriedade de unir vários íons metálicos, como os íons de ferro ferrosos Faith2+ e fé férrica3+.
Obtenção
De acordo com uma fonte consultada, o oxalato de sódio pode ser obtido oxidando oxigênio ou2 a uma temperatura de cerca de 250 ° C em uma solução concentrada de hidróxido de sódio NaOH.
Presença na natureza
O oxalato de sódio está presente em muitas plantas e vegetais, como acelga, espinafre e ruibarbo e em grãos como soja, entre muitos outros produtos vegetais.
 Espinafre tem muito oxalato de sódio. Autor: Aline Ponce. Fonte: Pixabay.
Espinafre tem muito oxalato de sódio. Autor: Aline Ponce. Fonte: Pixabay. Seu ácido ácido conjugado ocorre no organismo humano pelo metabolismo do ácido glicólico ou ácido ascórbico. Uma vez produzido, não é metabolizado, mas é excretado pela urina em forma de oxalato.
 Ruibarbo contém oxalato de sódio. Autores: s. Hermann & F. Richter. Fonte: Pixabay.
Ruibarbo contém oxalato de sódio. Autores: s. Hermann & F. Richter. Fonte: Pixabay. Formulários
Em Laboratórios de Análise Química
É usado como reagente químico, geralmente como um agente redutor, por exemplo, para a padronização de soluções de permanganato de potássio, isto é, para determinar exatamente quanta permanganato de sódio eles têm.
Na destruição de clorofluorocarbonetos
Oxalato de sódio tem sido usado para a destruição de clorofluorocarbonetos (CFC). Esses compostos CFC têm sido um dos responsáveis pela destruição da camada de ozônio do planeta (que nos protege da radiação ultravioleta).
Em 1996, alguns pesquisadores propuseram o uso de oxalato de sódio para eliminá-los, pois reage facilmente com o CFC a temperaturas de 270-290 ° C, tornando-os produtos inofensivos em direção à camada de ozônio.
A reação de oxalato de sódio com CFCs pode ser controlada para obter hidrocarbonetos aromáticos halogenados que não são prejudiciais à camada de ozônio, mas são compostos úteis na indústria química.
Pode atendê -lo: propileno glicol: estrutura, propriedades, síntese e usosEssa reação também pode ser levada ao máximo e converter todo o CFC em fluoreto de sódio naf, cloreto de sódio Soll, carbono elementar e dióxido de carbono Co2.
 A camada de ozônio do planeta nos protege dos raios ultravioleta do sol. Oxalato de sódio permite eliminar os compostos CFC que o danificam. Autor: One94. Fonte: Pixabay.
A camada de ozônio do planeta nos protege dos raios ultravioleta do sol. Oxalato de sódio permite eliminar os compostos CFC que o danificam. Autor: One94. Fonte: Pixabay. Ao determinar parâmetros importantes no tratamento de águas residuais
Verificou -se que o oxalato de sódio é útil para medir a quantidade e as classes de compostos orgânicos que secretam os microorganismos de lodo usados para tratar águas residuais.
A medida de tais compostos é importante para determinar sua função durante o tratamento das águas residuais, uma vez que a facilidade de separar a lama da água depende deles.
Usando oxalato de sódio, os inconvenientes de outros métodos são evitados.
Para obter ácido oxálico
Oxalato de sódio bruto a partir de resíduos de certos processos foi usado para produzir ácido oxálico H2C2QUALQUER4 em grandes quantidades.
O método usa lodo do processo Bayer para tratar a bauxita (um mineral de alumínio). No processo Bayer, a bauxita é tratada com hidróxido de sódio Naoh para dissolver a alumina deste mineral.
No processo de dissolução da alumina, certos compostos orgânicos presentes no mineral, como os ácidos húmicos, são atacados por NaOH, gerando uma grande quantidade de oxalato de sódio na2C2QUALQUER4.
Este oxalato de sódio é incorporado em uma lama com compostos de alumínio. Para purificá -lo, a montagem é dissolvida, é filtrada e passada através de uma coluna de troca de íons do tipo ácido ácido.
Na coluna, há uma resina de ácido sulfônico RSO3H onde os íons metálicos de Na são trocados+ por íons hidrogênio H+, Então você obtém ácido oxálico h2C2QUALQUER4.
Rso3H + Na2C2QUALQUER4 ⇔ RSO3Na + nahc2QUALQUER4
Pode atendê -lo: carbonato de potássio (K2CO3): estrutura, propriedades, usos, obtençãoRso3H + NAHC2QUALQUER4 ⇔ RSO3Na + h2C2QUALQUER4
Este é um processo econômico e o ácido oxálico obtido é de pureza aceitável.
Para remover compostos indesejados
Ácido oxalato de sódio conjugado, ácido oxálico H2C2QUALQUER4, É usado para dissolver certos tipos de resíduos e incrustações.
A característica do ácido oxálico de se tornar oxalato é usado agindo como um agente complexo ou precipitado, por exemplo, durante o processamento de resíduos de vários combustíveis nucleares.
O ácido oxálico também é usado para remover as incrustações de minerais e óxidos de ferro em tubos e outros equipamentos, isso se deve à sua capacidade de se juntar fortemente à fé de íons ferrosos2+ Como a fé de íons férrico3+ formando oxalatos.
Riscos
Se o oxalato de sódio for inalado ou ingerido diretamente. Produz vômitos, purga grave, pulso fraco, colapso cardiovascular, sintomas neuromusculares e danos nos rins.
As pessoas que tendem a formar cálculos nos rins devido ao acúmulo de oxalato na urina devem evitar consumir vegetais com um alto teor de oxalatos solúveis, como o sódio.
Oxalato de sódio em grandes quantidades nos alimentos ao atingir a urina se liga ao cálcio presente nisso e pode produzir cálculos ou pedras de oxalato de cálcio nos rins para pessoas que tendem a fazê -lo.
 Oxalato de sódio de alguns alimentos pode levar à formação de pedras nos rins de pessoas com predisposição. Autor: Azwer. Fonte: Pixabay.
Oxalato de sódio de alguns alimentos pode levar à formação de pedras nos rins de pessoas com predisposição. Autor: Azwer. Fonte: Pixabay. Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Oxalato de sódio. Centro Nacional de Informações sobre Biotecnologia. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Chai, w. E Liebman, M. (2005). Efeito de diferentes métodos de cozimento no teor de oxalato vegetal. J. Agric. Food Chem. 2005, 53, 3027-3030. Recuperado de bares.ACS.org.
- Dagani, r. (mil novecentos e noventa e seis). CFC destruindo Reion. Arquivo de notícias químicas e engenharia 1996, 74, 4, 6-7. Recuperado de bares.ACS.org.
- Sajad, m. e Kim, K.S. (2016). Extração de substâncias poliméricas extracelulares do lodo ativado usando oxalato de sódio. Int. J. Ambiente. Sci. Technol. 13, 1697-1706 (2016). Link recuperado.Springer.com.
- Jeffrey, g.PARA. E Parry, G.S. (1954). A estrutura cristalina de oxalato de sódio. J. SOU. Chem. Soc. 1954, 76, 21, 5283-5286. Recuperado de bares.ACS.org.
- Okuwaki, a. et al. (1984). Produção de oxalato pela oxidação do carvão com oxigênio em uma solução de hidróxido de sódio concentrado. Ind. Eng. Chem. Prod. Carne bovina. Dev. 1984, 23, 648-651. Recuperado de bares.ACS.org.
- Hefter, g. et al. (2018). Soluubilidade do oxalato de sódio em soluções de eletrólitos concentrados. J Chem & Eng Data. 2018, 63, 3, 542-552. Recuperado de bares.ACS.org.
- La k. Yo. (1992). Processo para a preparação de ácido oxálico e hidrogênio oxalato de sódio a partir de oxalato de sódio bruto. OU.S. Patente No. 5.171.887. DEC.15, 1992. Recuperado da FreepatentSsonline.com.
- « Haptes História, Funções, Características, Respostas Inmunes
- Estrutura do tripolifosfato de sódio (Na5p3310), propriedades, usos, impacto, impacto »

