Orbitais degenerados

- 4442
- 962
- Gilbert Franecki
 Esquema de energia com os orbitais ocupados por elétrons ausentes. Fonte: Gabriel Bolívar
Esquema de energia com os orbitais ocupados por elétrons ausentes. Fonte: Gabriel Bolívar O Orbitais degenerados Eles são aqueles encontrados no mesmo nível de energia. De acordo com esta definição, eles devem ter o mesmo número quântico principal n. Assim, os orbitais 2s e 2p são degenerados, pois pertencem ao nível de energia 2, embora se saiba que suas funções de ondas angulares e radiais são diferentes.
Como os valores de n, Os elétrons começam a ocupar outros sub -níveis de energia, como D e F orbitais.
Cada um desses orbitais tem suas próprias características, que à primeira vista são observadas em suas formas angulares; Estas são as figuras esféricas, de halteres (p), de folhas de trevo (d) e globular (f).
Entre eles, há uma diferença de energia, até pertencente ao mesmo nível n.
Por exemplo, um esquema de energia com os orbitais ocupados por elétrons ausentes (um caso anormal) é mostrado na imagem superior (um caso anormal).
Pode -se observar que de todos, o mais estável (a menor energia) é o ns orbital (1s, 2s, ...), enquanto o NF é o mais instável (aquele com a maior energia).
Orbitais degenerados de um átomo isolado
Orbitais degenerados, com o mesmo valor que n, Eles estão na mesma linha em um esquema de energia.
Por esse motivo, as três listras vermelhas que simbolizam os orbitais P estão localizadas na mesma linha; Como da mesma maneira faz as listras roxas e amarelas.
O esquema de imagem viola a regra do coletor: os orbitais de maior energia são preenchidos com elétrons.
Pode atendê -lo: ácidos e bases: diferenças, características, exemplosQuando os elétrons acasalam, o orbital perde energia e exerce uma maior repulsão eletrostática nos elétrons ausentes dos outros orbitais.
No entanto, esses efeitos não são considerados em muitos diagramas de energia. Se sim.
Como afirmado acima, cada orbital tem suas próprias características. Um átomo isolado, com sua configuração eletrônica, está disposto a seus elétrons no número preciso de orbitais que lhes permitem hospedá -los.
Somente aqueles em energia podem ser considerados degenerados.
Orbitais p
As três listras vermelhas para os orbitais da imagem da imagem indicam que ambos Px, pe E Pz Eles têm a mesma energia.
Há um elétron desaparecido em cada um, descrito por quatro números quânticos (n, eu, ml e EM), enquanto os três primeiros descrevem os orbitais.
A única diferença entre eles é denotada pelo momento magnético ml, que desenha a trajetória de Px Em um eixo x, pe no eixo y e pz no eixo z.
Os três são iguais, mas diferem apenas em suas orientações espaciais. Por esse motivo, eles são sempre desenhados em energia, isto é, degenerar.
Como são os mesmos, um átomo de nitrogênio inomotivo (com configuração 1S22s22 p3) Você deve manter seus três orbitais degenerados. No entanto, o cenário de energia muda abruptamente se for considerado um átomo de N dentro de uma molécula química ou composto.
É assim porque, embora Px, pe E Pz Eles são iguais em energia, isso pode variar em cada um deles se tiverem diferentes ambientes químicos; isto é, se eles estiverem ligados a diferentes átomos.
Pode atendê -lo: Isopreno: Estrutura, Propriedades, AplicaçõesOrbitais d
As cinco listras roxas denotam os orbitais D. Em um átomo isolado, mesmo que eles tenham emparelhados elétrons, eles são considerados que esses cinco orbitais são degenerados. No entanto, diferentemente dos orbitais P, desta vez há uma diferença acentuada em suas formas angulares.
Portanto, seus elétrons viajam direções no espaço que variam de um orbital D a outro.
Isso causa, de acordo com o Teoria do campo cristalino, que um distúrbio mínimo causa um energia se desenrolando dos orbitais; Ou seja, as cinco listras roxas separadas, deixando uma lacuna de energia entre elas:
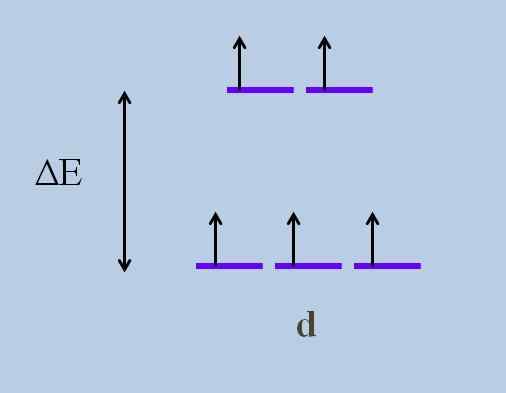 Esquema de desdobramento de energia de orbitais. Fonte: Gabriel Bolívar
Esquema de desdobramento de energia de orbitais. Fonte: Gabriel Bolívar Quais são os orbitais acima e quais são os abaixo? Os acima são simbolizados como eg, e aqueles abaixo t2 g.
Observe como inicialmente todas as listras roxas estavam alinhadas e agora um conjunto de dois orbitais foi formado eg mais energia do que o outro conjunto de três orbitais t2 g.
Essa teoria permite explicar as transições D-D, para as quais muitas das cores observadas nos compostos dos metais de transição (Cr, Mn, Faith etc. são concedidos.).
Esse distúrbio eletrônico se deve às interações de coordenação do centro de metal com outras moléculas chamadas Ligantes.
Orbitais f
E com os orbitais f, as sete listras amarelas, a situação é ainda mais complicada. Seus endereços espaciais variam muito entre eles, e a visualização de seus links se torna muito complexa.
De fato, considera -se que os orbitais f são de uma camada tão interna que eles não "participam consideravelmente" na formação de links.
Pode atendê -lo: óxido perclórico (CL2O7)Quando o átomo isolado com os orbitais F é cercado por outros átomos, ocorre as interações e o desdobramento (perda de degeneração):
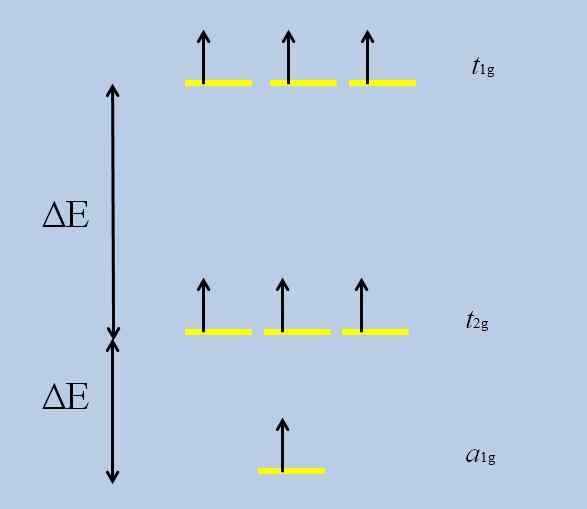 Esquema de perda de degeneração. Fonte: Gabriel Bolívar
Esquema de perda de degeneração. Fonte: Gabriel Bolívar Observe que agora as listras amarelas formam três conjuntos: t1g, t2 g e para1g, E eles não estão mais degenerados.
Orbitais híbridos degenerados
Tem visto que os orbitais podem estar se desenrolando e perdendo degeneração. No entanto, embora isso explique transições eletrônicas, não esclarece como e por que existem diferentes geometrias moleculares. Aqui os orbitais híbridos entram.
Sua principal característica é que eles estão degenerados. Assim, eles surgem da mistura de caracteres orbitais S, P, D e F, para causar híbridos degenerados.
Por exemplo, três orbitais P são misturados com um S para dar quatro orbitais de SP3. Todos os orbitais de SP3 Eles são degenerados e, portanto, têm a mesma energia.
Se adicionalmente dois orbitais forem misturados com os quatro SP3, Seis orbitais serão obtidos3d2.
E como as geometrias moleculares explicam? Como existem seis, com energias iguais, eles devem ser guiados simetricamente no espaço para gerar ambientes químicos iguais (por exemplo, em um composto MF6).
Quando o fazem, é formado um octaedro de coordenação, o que é igual a uma geometria octaédrica em torno de um centro (M).
No entanto, as geometrias geralmente apresentam distorções, o que significa que mesmo os orbitais híbridos não são completamente degenerados.
Portanto, como conclusão, os orbitais degenerados existem apenas em átomos isolados ou ambientes altamente simétricos.
Referências
- Definição de desgerato. Recuperado de: Chemicool.com
- Átomos e orbitais atômicos. Recuperado de notas de faísca.com
- Whitten, Davis, Peck e Stanley. Química. (8.ª Ed.). Cengage Learning.

