Sem história de metais, propriedades, grupos, usa

- 1271
- 40
- Alfred Kub
O Sem metais Eles são um grupo de elementos localizados no lado direito da tabela periódica, com exceção do hidrogênio localizado no Grupo 1 (AI), juntamente com metais alcalinos. Se você quiser saber o que eles são, precisa olhar para o canto superior direito do bloco P.
Os átomos não -metal são relativamente pequenos e sua camada eletrônica externa tem um número elevado de elétrons. Entre os elementos não metálicos, sólidos, líquidos e gases podem ser encontrados; Embora estejam principalmente em um estado gasoso, vários deles enriquecendo a atmosfera.
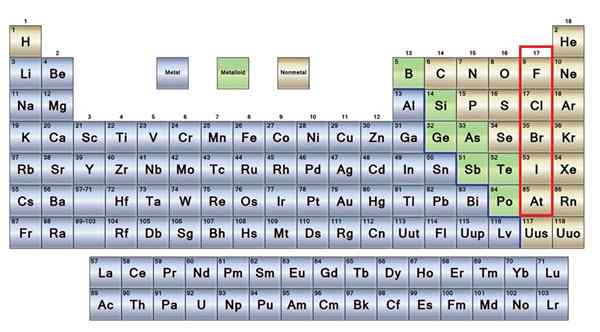 Elementos não -metálicos em marrom
Elementos não -metálicos em marrom Boa parte dos não -metais estão presentes em todos os seres vivos na forma de compostos e macromoléculas. Por exemplo: carbono, oxigênio e hidrogênio estão presentes em todas as proteínas, lipídios, carboidratos e ácidos nucleicos.
O fósforo está presente em todos os ácidos nucleicos e em alguns carboidratos e lipídios. Enxofre é encontrado em muitas proteínas. O nitrogênio faz parte de todos os ácidos nucleicos e proteínas.
Por outro. De fato, hidrocarbonetos (carbono e hidrogênio) dão uma idéia de quão abundantes os não -metais são, apesar do menor número de elementos na tabela periódica.
[TOC]
História
Da antiguidade (3750 a.C.) Os egípcios usaram carvão para reduzir o cobre presente em seus minerais, como o Corvelita e a malaquita.
Em 1669, a marca de hennin conseguiu isolar o fósforo de urina coletada. Henry Cavendish (1776) alcançou a identificação de hidrogênio, embora vários pesquisadores, incluindo Robert Boyle (1670), produziram hidrogênio reagindo um ácido forte com um metal.
Carl Scheele produziu oxigênio por aquecimento de óxido de mercúrio com nitratos (1771). Curtois conseguiu isolar o iodo, enquanto tentava preparar Saltpeters de Seaweed (1811). Balard e Gmelin isolaram o Bome (1825).
Em 1868, Janssen e Lockger Independent. Moissan conseguiu isolar o flúor (1886).
Em 1894, Lord Rayleigh e Ramsey descobriram o argônio estudando propriedades de nitrogênio. Ramsay e Travers (1898) isolaram o Crypton, Neon e Xenon do argônio líquido, por destilação criogênica do ar.
Propriedades físicas e químicas
 O enxofre é um dos elementos não -metálicos mais representativos. Fonte: Ben Mills via Wikipedia.
O enxofre é um dos elementos não -metálicos mais representativos. Fonte: Ben Mills via Wikipedia. Físico
Algumas das propriedades físicas dos não -metais são:
-Eles têm baixa condutância elétrica, exceto o carbono na forma de grafite, que é um bom condutor de eletricidade.
Pode atendê -lo: heptano (c7h16): estrutura, propriedades e usos-Eles podem ocorrer sob a aparência física de sólidos, líquidos ou gases.
-Eles têm baixa condutância térmica, com exceção do carbono na forma de diamante que não se comporta como um isolador térmico.
-Eles têm pouco brilho, ao contrário do brilho de metal de metal.
-Sólidos não metálicos são quebradiços, então não são dúcteis ou maleáveis.
-Eles têm pontos de fusão e fervura baixa.
-Eles podem apresentar diferentes estruturas cristalinas. Assim, fósforo, oxigênio e fluoreto têm uma estrutura cristalina cúbica; Hidrogênio, carbono e nitrogênio, hexagonal; e enxofre, cloro, bromo e iodo, ortorrombic.
Química
Os não metais são caracterizados por ter alta energia de ionização e um alto valor de eletronegatividade. A fluorina, por exemplo, tem a maior eletronegatividade (3,98), sendo o elemento mais reativo de não -metais.
Mas, surpreendentemente, os gases nobres hélio (5,5) e neon (4,84) têm a maior eletronegatividade. No entanto, eles são quimicamente inertes por ter camadas eletrônicas externas cheias.
Não metais formam compostos iônicos com metais e covalentes com não -metais.
Elementos não -metálicos estão formando moléculas diatômicas, ligadas por ligações covalentes. Enquanto isso, os átomos dos gases nobres estão na forma de unidades atômicas.
Eles formam óxidos ácidos que reagem com a água originam ácidos.
Grupos de não metal e elementos

Grupo 1
É constituído pelo hidrogênio um gás incolor e vaso sanitário, dialotômico. Estado de oxidação +1. Tem menos densidade do que o ar. No estado sólido, apresenta uma estrutura cristalina hexagonal. Hidrogênio é um pequeno elemento reativo.
Grupo 14
Carbono é o único não -metal pertencente a este grupo. Carbono na forma de grafite é um sólido lustroso, com uma estrutura cristalina hexagonal. Tem alta condutividade elétrica. Seus estados de oxidação mais comuns são +2 e +4.
Grupo 15
Azoto
Gás incolor e vaso sanitário. É um pouco de elemento reativo e um pouco mais denso que o ar. Estados mais comuns de oxidação: -3 e +5. Moléculas diatômicas de forma, n2.
Corresponder
Sólido, sua cor pode ser branca, amarela ou preta. Pequeno reativo. Estrutura cristalina ortorrômbica. Eletronegatividade 2,1. Estados mais comuns de oxidação: -3 e +5.
Grupo 16
Oxigênio
Gás incolor ou azul pálido, banheiro. Geralmente não é reativo. Estrutura cristalina cúbica. É um isolador e um forte agente oxidante. Eletronegatividade 3.5. Estado de oxidação -2
Enxofre
Amarelo brilhante sólido, quebradiço, moderadamente reativo. Estrutura cristalina ortorrômbica. Formar ligações covalentes. Eletronegatividade 2.5. Estados mais comuns de oxidação: -2, +2, +4 e +6.
Selênio
Black Cinza ou sólido avermelhado. O selênio cinza mostra condutividade elétrica sensível à luz. É um sólido macio e quebradiço. Eletronegatividade 2.4. Estados de oxidação: -2, +2, +4 e +6.
Pode atendê -lo: hidróxido de potássio: estrutura, propriedades, usosGrupo 17
Flúor
É um gás amarelo pálido, muito tóxico. É um elemento muito reativo. É apresentado como moléculas diatômicas, f2. Em estado sólido cristaliza em uma forma cúbica. Eletronegatividade 3,98. Estados de oxidação -1.
Cloro
É um gás amarelo verde. Apresenta moléculas diatômicas, CL2. É muito reativo. Em estado sólido, a estrutura cristalina é ortorrômbica. Eletronegatividade 3.0. Estados de oxidação: - 1, +1, +3, +5, +7.
Bromo
É um fluido de capere vermelho. Eletronegatividade 2.8. Estados de oxidação -1, +1, +3, +5 e +7.
Iodo
É um sólido preto que, quando sublimados, emite um vapor violeta. Estrutura cristalina ortorrômbica. Iodetos de metal são iônicos. Eletronegatividade 2.5. Estados de oxidação: -1, +1, +3, +5, y +7.
Astato
É um sólido preto. Estrutura cristalina cúbica centrada no rosto. Eletronegatividade 2,2. É um agente oxidante fraco.
Grupo 18
Hélio
Tem alta condutividade térmica. Eletronegatividade 5.5. É quimicamente inerte e não inflamável. Baixa densidade e alta fluidez.
Néon
Alta capacidade de resfriamento em estado líquido. Eletronegatividade 4.84. É o menos reativo de gases nobres.
Argônio
É mais denso que o ar. Quimicamente inerte. Eletronegatividade 3.2.
Krypton
Eletronegatividade 2,94. Pode reagir com o fluoreto para formar o difluoreto de Crypton (KRF2).
Xenon
Atravessa a barreira do cérebro sanguíneo. Responde à corrente elétrica produzindo luz. Eletronegatividade 2,2. Forma complexa com flúor, ouro e oxigênio.
Radônio
É um elemento radioativo. Eletronegatividade 2.06. Formulário compostos com flúor (RNF2) e com oxigênio (RNO3).
Formulários
Hidrogênio

É usado em propulsão de foguetes e como combustível em motores de carro que usam hidrogênio. É usado na síntese de amônia (NH3) e na hidrogenação de gorduras.
Carbono
A grafite é usada na fabricação de lápis e fibras de alta resistência que são usadas na elaboração de artigos esportivos. O diamante é usado como uma jóia de grande valor e nos exercícios de perfuração como abrasivo. O dióxido de carbono é usado na elaboração de refrigerantes.
Azoto
É usado na produção de amônia, ácido nítrico e uréia. O nitrogênio é um elemento essencial para as plantas e é usado na fabricação de fertilizantes.
Corresponder
O fósforo branco é usado como raticida, inseticida e na indústria pirotécnica. O fósforo vermelho é usado na fabricação de fósforos. Seus compostos também são usados na elaboração de fertilizantes.
Oxigênio
O oxigênio é usado na elaboração de aço, plásticos e têxteis. Também é usado em foguetes, oxigenoterapia e assistência respiratória em aeronaves, submarinos e voos espaciais.
Pode atendê -lo: erbio: estrutura, propriedades, obtenção, usosEnxofre
É usado como matéria -prima para a produção de ácido sulfúrico, pólvora e na vulcanização de borrachas. Sulfitos são usados para branquear papel e fungicida.
Selênio
É usado para transmitir uma coloração vermelha escarlate ao vidro. Também é usado para neutralizar nuances esverdeadas produzidas pela poluição por vidro com compostos de ferro. É usado em células fotoelétricas com aplicação em portas e elevadores.
Flúor

É adicionado a cremes dentários para evitar cáries. O fluoreto de hidrogênio é usado como matéria -prima para Teflon. O fluor monoatômico é usado na fabricação de semicondutores.
Cloro
É usado em metalurgia extrativa e cloração de hidrocarbonetos para a fabricação de diversos produtos, como o PVC. O cloro é usado em madeira e branqueamento de celulose têxtil. Também é usado como desinfetante da água.
Bromo
É usado na preparação de brometo de prata para lentes sensíveis à luz e em filmes fotográficos, também é usado na elaboração do brometo de sódio sedativo e dibrometano, um componente anti -domínio da gasolina.
Iodo
O iodeto de potássio (KI) é adicionado para impedir o bócio da tireóide. A tintura de iodo é usada como anti -séptica e germicida. O iodo faz parte dos hormônios da tireóide.
Hélio
É usado no recheio de balões de ar quente e misturado com oxigênio para respiração em águas profundas. É usado para soldas em uma atmosfera inerte e ajuda a manter temperaturas de pesquisa muito baixas.
Néon
Em tubos de vidro que iluminam a ação da eletricidade (luzes vermelhas neon).
Argônio
É usado para criar uma atmosfera para soldagem e no preenchimento de holofotes de incandescência.
Xenon
Uma mistura de xenônio e cripton é usada na produção de flashes de grande intensidade na exposição fotográfica de curto prazo.
Radônio
É usado no tratamento de tumores canceros por radioterapia.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Mathews, c. K., Van holde, k. E. E Ahern, k. G. (2002). Bioquímica. Terceira edição. Editar. Pearson-Addison Wesley
- Helmestine, Anne Marie, Ph.D. (6 de outubro de 2019). Quais são as propriedades dos não -metais? Recuperado de: pensamento.com
- Wikipedia. (2019). Metalóide. Recuperado de: em.Wikipedia.org
- Os editores da Enyclopaedia Britannica. (5 de abril de 2016). Metalóide. Encyclopædia britannica. Recuperado de: Britannica.com
- Jose m. Gavira Vallejo. (27 de janeiro de 2016). Quais são os pnicogênios? E os iconosognos, os cristalógenos, os calcógenos .. ? Recuperado de: Triplenlace.com
- « História da Fluor, propriedades, estrutura, obtenção, riscos, usos
- O que é, tipos e características »

