História da Fluor, propriedades, estrutura, obtenção, riscos, usos
- 4859
- 287
- Alfred Kub
Ele flúor É um elemento químico representado com o símbolo F e o grupo de cabeças 17, ao qual os halogênios pertencem. É distinguido acima dos outros elementos da tabela periódica, por ser o mais reativo e eletronegativo; reage quase com todos os átomos, por isso forma inúmeros sais e compostos organizacionais.
Em condições normais, é um gás amarelo pálido, que pode ser confundido com verde amarelado. No estado líquido, mostrado na imagem inferior, sua cor amarela se intensifica um pouco mais, o que desaparece completamente quando solidifica em seu ponto de congelamento.
 Fluorina líquida em um tubo de ensaio. Fonte: Fulvio314 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Fluorina líquida em um tubo de ensaio. Fonte: Fulvio314 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] É essa reatividade, apesar do volátil de seu gás, que permanece preso na crosta terrestre; especialmente na forma de mineral de fluorita, conhecido por seus cristais violeta. Da mesma forma, sua reatividade o torna uma substância potencialmente perigosa; reaja vigorosamente com tudo o que toca e queima em chamas.
No entanto, muitos de seus produtos derivados podem ser inofensivos e até benéficos, dependendo de suas aplicações. Por exemplo, o uso mais popular de flúor, adicionado em sua forma iônica ou mineral (como sais de flúor), consiste na preparação de pastas dentárias com fluoreto, que ajudam a proteger o esmalte dental.
A fluorina apresenta a peculiaridade de que altos números ou estados de oxidação podem se estabilizar para muitos outros elementos. Quanto maior o número de átomos de flúor, mais reativo será o composto (a menos que seja um polímero). Da mesma forma, seus efeitos com matrizes moleculares aumentarão; Para o bem ou para o mal.
[TOC]
História
Uso de fluorito
Em 1530, o mineralogista alemão Georgius Agricola descobriu que o Fluorspar Mineral poderia ser usado na purificação de metal. Fluorspar é outro nome para Fluorite, um mineral de flúor que consistia em fluoreto de cálcio (CAF2).
O elemento flúor não havia sido descoberto até então e o "fluoir" no fluorito veio da palavra latina "fluere", que significa "fluxo"; Desde então, foi isso que o fluorspar ou o fluorito fez com os metais: os ajudou a deixar a amostra.
Preparação de ácido fluorérico
Em 1764, Andreas Sigismud Margraff gerenciou. Retornos de vidro derretidos pela ação do ácido, então o vidro foi substituído por metais.
Também é atribuído a Carl Scheele em 1771, a preparação de ácido pelo mesmo método seguido por Margraff. Em 1809, o cientista francês Andre-Marie Ampere propôs que o ácido fluoric ou fluorérico era um composto formado por hidrogênio e um novo elemento semelhante ao cloro.
Os cientistas tentaram isolar a flúor através do uso de ácido fluorérmico por um longo tempo; Mas seu perigo fez progresso nesse sentido.
Humphry Davy, Joseph Louis Gay-Lussac e Jacques Thénard tiveram forte dor ao inalar o fluoreto de hidrogênio (ácido de fluoreto sem água e em uma forma gasosa)). Em circunstâncias semelhantes, os cientistas Paulin Louyet e Jerome Nickles morreram por envenenamento.
Edmond Fréme, pesquisador francês, tentou criar ácido fluorforide seco para evitar a toxicidade do fluoreto de hidrogênio pela acidificação do bifluoreto de potássio (KHF2), Mas durante a eletrólise, não houve condução de corrente elétrica.
Isolamento
Em 1860, o químico inglês George Gore tentou. No entanto, houve uma explosão recombando violentamente hidrogênio com fluoreto. Gore atribuiu a explosão a um vazamento de oxigênio.
Em 1886, o químico francês Henri Moisson conseguiu isolar o flúor pela primeira vez. Anteriormente, o trabalho de Moisson foi interrompido quatro vezes devido a envenenamento grave com fluoreto de hidrogênio, enquanto tentava isolamento do elemento.
Moisson era um estudante de Frony e foi baseado em seus experimentos para isolar o fluoreto. Moisson usado em eletrólise Uma mistura de fluoreto de potássio e ácido fluorhorrérmico. A solução resultante LED eletricidade e gás flúor acumulados no ânodo; isto é, no eletrodo carregado positivamente.
Moisson usou um equipamento resistente à corrosão, no qual os eletrodos eram feitos de uma liga de platina e irídio. Na eletrólise, usou um recipiente de platina e resfriou a solução eletrolítica a uma temperatura de -23 ºF (-31 ºC).
Finalmente, em 26 de junho de 1886, Henri Moisson conseguiu isolar o fluoreto, um trabalho que lhe permitiu ganhar o Prêmio Nobel em 1906.
Interesse em fluoreto
Por um tempo o interesse em investigação com flúor foi perdido. No entanto, o desenvolvimento do projeto de Manhattan para a produção da bomba atômica.
A empresa americana DuPont se desenvolveu, entre 1930 e 1940, produtos fluorados, como clorofluorocarbonatos (Freon-12), usados como refrigerantes; e PolyTetrafluoroetileno Plástico, conhecido mais conhecido com o nome Teflon. Isso produziu um aumento na produção e consumo de flúor.
Em 1986, em uma conferência para um século de isolamento de flúor, o químico americano Karl ou. Christe apresentou um método químico para a preparação do fluoreto por reação entre k2Mnf6 e o SBF5.
Pode servir você: álcool polivinílicoPropriedades físicas e químicas
Aparência
A flúor é um gás amarelo pálido. Em estado líquido é amarelo brilhante. Enquanto isso, o sólido pode ser opaco (alfa) ou transparente (beta).
Número atômico (Z)
9.
Peso atômico
18.998 u.
Ponto de fusão
-219.67 ºC.
Ponto de ebulição
-188.11 ºC.
Densidade
À temperatura ambiente: 1.696 g/l.
No ponto de fusão (líquido): 1.505 g/ml.
Calor de vaporização
6,51 kJ/mol.
Capacidade calórica molar
31 J/(mol · k).
Pressão de vapor
A uma temperatura de 58 K tem uma pressão de vapor de 986,92 atm.
Condutividade térmica
0,0277 W/(M · K)
Ordem magnética
Diamagnético
Cheiro
Cheiro característico picante e penetrante, detectável mesmo em 20 ppb.
Números de oxidação
-1, que corresponde ao ânion fluoreto, f-.
Energia de ionização
-Primeiro: 1.681 KJ/mol
-Segundo: 3.374 KJ/mol
-Terceiro: 6.147 KJ/mol
Eletro-negatividade
3,98 na escala Pauling.
É o elemento químico com a maior das eletronegatividades; isto é, tem uma alta afinidade pelos elétrons dos átomos com os quais está ligado. Por esse motivo, os átomos de flúor geram grandes momentos dipolares em regiões específicas de uma molécula.
Sua eletronegatividade também tem outro efeito: os átomos ligados a ele perdem tanta densidade eletrônica que começam a adquirir uma carga positiva; Este é um número de oxidação positivo. Quanto mais átomos de flúor em um composto, o átomo central terá um número de oxidação mais positivo.
Por exemplo, no de2 Oxigênio tem um número de oxidação de +2 (ou2+F2-); No uf6, O urânio tem um número de oxidação de +6 (u6+F6-); O mesmo vale para enxofre no SF6 (S6+F6-); E finalmente é o AGF2, onde prata ainda tem um número de oxidação de +2, incomum.
Portanto, os elementos conseguem participar com seus números de oxidação mais positivos quando formam compostos com fluoreto.
Agente oxidante
A fluorina é o elemento oxidante mais poderoso, portanto, nenhuma substância é capaz de oxidá -la; E por esse motivo, ele não é de natureza livre.
Reatividade
A fluorina é capaz de combinar com todos os outros elementos, exceto com hélio, neon e argônio. Também não atacam aço doce ou cobre em temperaturas normais. Reagir violentamente com materiais orgânicos, como borracha, madeira e tecido.
O fluoreto pode reagir com o xenônio de gás nobre para formar o forte oxidante difluoruro de xenônio, xef2. Ele também reage com hidrogênio para formar um halogeneto, fluoreto de hidrogênio, HF. Por sua vez, o fluoreto de hidrogênio é dissolvido em água para produzir o famoso ácido fluorhoréricico (vidro de comer).
A acidez dos ácidos hidrace, classificados em ordem crescente é:
HF < HCl < HBr < HI
O ácido nítrico reage com o fluoreto para formar nitrato de flúor, FNO3. Enquanto isso, o ácido clorídrico reage vigorosamente com o fluoreto para formar HF, de2 e clf3.
Estrutura e configuração eletrônica

Molécula diatômica
 Molécula de fluoreto representada com modelo de enchimento de espaço. Fonte: Gabriel Bolívar.
Molécula de fluoreto representada com modelo de enchimento de espaço. Fonte: Gabriel Bolívar. O átomo de fluorina em seu estado basal possui sete elétrons de Valência, que estão nos orbitais 2s e 2p de acordo com a configuração eletrônica:
[Ele] 2s2 2 p5
A teoria do Link de Valencia (TEV) estabelece que dois átomos de flúor, F, estão covalentemente ligados para poder completar seu octeto em Valencia cada.
Isso ocorre rapidamente, porque mal não tem um elétron para se tornar isoletrônico a nobres gás neon; E seus átomos são muito pequenos, com uma carga nuclear eficaz muito forte que exige facilmente elétrons do ambiente.
A molécula f2 (Imagem superior), tem um link covalente simples, F-F. Apesar de sua estabilidade em comparação com os átomos F livres, é uma molécula extremamente reativa; Homonuclear, apolar e ansioso por elétrons. É por isso que o fluoreto, como f2, É uma espécie muito tóxica e perigosa.
Porque o f2 É apolar, suas interações dependem de sua massa molecular e das forças de dispersão de Londres. Em algum momento, a nuvem eletrônica em torno de ambos os átomos F deve se deformar e originar um dipolo instantâneo que induz outro em uma molécula vizinha; para que sejam lentamente e fracos.
Líquido e sólido
A molécula f2 É muito pequeno e se espalha no espaço com velocidade relativa. Em sua fase gasosa, exibe uma cor amarela pálida (que pode ser confundida com um verde limão). Quando a temperatura cai para -188 ºC, as forças de dispersão se tornam mais eficazes e tornam as moléculas f2 coesão o suficiente para definir um líquido.
O fluorina líquido (primeira imagem) parece ainda mais amarela do que seu respectivo gás. Nele, as moléculas f2 Eles estão mais próximos e interagem com a luz em maior grau. Curiosamente, uma vez que o vidro cúbico distorcido é formado de flúor a -220 ºC, a cor desaparece e permanece um sólido transparente.
Pode atendê -lo: alcanes ramificadosAgora que as moléculas M2 Eles são tão próximos (mas sem suas rotações moleculares param), parece que seus elétrons ganham alguma estabilidade e, portanto, seu salto eletrônico é muito grande para a luz interagir com o vidro.
Fases cristalinas
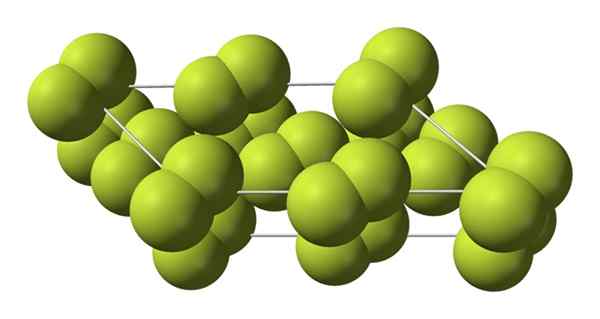
Este cristal cúbico corresponde à fase β (não é um almotrópico porque permanece o mesmo2). Quando a temperatura cai ainda mais, até -228 ºC, a fluorina sólida sofre uma transição de fase; O vidro cúbico é transformado em uma fase monoclínica, a fase α:
 Estrutura cristalina da fase alfa de flúor. Fonte: Benjah-BMM27 [Domínio Público].
Estrutura cristalina da fase alfa de flúor. Fonte: Benjah-BMM27 [Domínio Público]. Ao contrário de β-f2, O α-f2 é opaco e duro. Talvez seja porque as moléculas M2 Eles não têm mais tanta liberdade para girar em suas posições fixas em cristais monoclínicos; onde eles interagem em maior grau com a luz, mas sem excitar seus elétrons (o que explicaria superficialmente sua opacidade).
A estrutura cristalina de α-f2 Era difícil estudar através de métodos convencionais de difração de raio x. Isso ocorre porque a transição da fase β para α é muito exotérmica; Então o cristal praticamente explorado, enquanto interage pouco com radiação.
Eles passaram cerca de cinquenta anos antes de os cientistas alemães (Florian Kraus e colaboradores), decifrar completamente a estrutura α-F2 com maior precisão graças às técnicas de difração de nêutrons.
Onde está e obtenha
Fluorine ocupa o dia 24 dos elementos mais comuns no universo. No entanto, na terra está em massa os 13Vo elemento, com uma concentração de 950 ppm na crosta terrestre e uma concentração de 1,3 ppm na água do mar.
Os solos têm uma concentração de flúor entre 150 e 400 ppm e, em alguns solos, a concentração pode atingir 1.000 ppm. No ar atmosférico, está presente em uma concentração de 0,6 ppb; Mas ele se registrou em algumas cidades de até 50 ppb.
A flúor é obtida principalmente de três minerais: fluorito ou fluorospar (café2), O fluoroapatita [CA5(Po4)3F] e o crioulo (na3Alf6).
Processamento de fluorita
Depois de coletar as rochas com o mineral de fluorita, elas estão sujeitas a esmagamento primário e secundário. Com o esmagamento secundário de obter fragmentos de rocha muito pequenos.
Então, fragmentos de rocha são levados para um moinho de bolas para redução de poeira. Água e reagentes são adicionados para formar uma pasta, que é colocada em um tanque de flutuação. É injetado com pressão para formar bolhas e, portanto, o fluorito acaba na superfície aquosa.
Silicatos e carbonatos são sedimentos enquanto o fluorito é coletado e leva a fornos de secagem.
Depois que o fluorito é obtido, ele é reagido com ácido sulfúrico para produzir fluoreto de hidrogênio:
Caf2 + H2SW4 => 2 hf +caso4
Eletrólise de fluoreto de hidrogênio
Na produção de fluoreto, algumas modificações são seguidas, com o método usado por Moisson em 1886.
É feita uma eletrólise de uma mistura de fluoreto de potássio fundido e ácido fluo -hídrico, com um raio molar de 1: 2,0 a 1: 2.2. A temperatura de sal fundido é de 70 - 130 ºC.
O cátodo consiste em uma liga monet ou de aço, e o ânodo é de reeografar carvão. O processo de produção de flúor durante a eletrólise pode ser esquematizado da seguinte forma:
2hf => h2 + F2
A água é usada para resfriar a câmara de eletrólise, mas a temperatura deve estar acima do ponto de fusão do eletrólito para evitar solidificação. O hidrogênio produzido em eletrólise é coletado no cátodo, enquanto o fluoreto no ânodo.
Isótopos
O fluoreto tem 18 isótopos, sendo o 19F O único isótopo estável com 100% de abundância. Ele 18F tem meia -vida de 109,77 minutos e é o isótopo radioativo de flúor com a maior meia -vida. Ele 18F é usado como uma fonte de positron.
Artigo biológico
Nenhuma atividade metabólica da flúor em mamíferos ou plantas superiores é conhecida. No entanto, algumas plantas do mar e esponjas sintetizam o monofluroacetato, um composto venenoso, que usa como proteção para evitar a destruição.
Riscos
O consumo excessivo de fluorina tem sido associado à fluorose óssea em adultos e fluorose dentária em crianças, bem como a alterações no funcionamento renal. Por esse motivo, o Serviço de Saúde Pública dos Estados Unidos (PHS) sugeriu que a concentração de fluoreto na água potável não deveria ser maior que 0,7 mg/L.
Enquanto isso, a Agência de Proteção Ambromental dos EUA (EPA) estabeleceu que a concentração de fluoreto na água potável não deve ser maior que 4mg/L, a fim de evitar a fluorose esquelética, na qual o fluoreto se acumula nos ossos. Isso pode causar enfraquecimento e fraturas ósseas.
A flúor tem sido relacionada a danos à glândula paratireóide, com uma diminuição no cálcio nas estruturas ósseas e altas concentrações de cálcio no plasma.
Pode servir a você: Matéria Viva: Conceito, Características e ExemplosEntre as alterações atribuídas ao excesso de flúor estão as seguintes: fluorose dentária, fluorose esquelética e danos à glândula paratireóide.
Fluorose dentária
A fluorose dentária é apresentada com pequenas listras ou motocicletas no esmalte de dente. Crianças menores de 6 anos não devem usar enxaguatório bucal contendo fluoreto.
Fluorose esquelética
Na fluorose esquelética, podem ser diagnosticados danos e danos à dor e da dor, bem como nas articulações. O osso pode endurecer e perder a elasticidade, o que aumenta o risco de fraturas.
Formulários
Pasta de dentes
 Alguns sais inorgânicos de flúor são usados como aditivo na formulação de pastas dentárias, que mostraram que elas ajudam a proteger o esmalte dental. Fonte: pxhere.
Alguns sais inorgânicos de flúor são usados como aditivo na formulação de pastas dentárias, que mostraram que elas ajudam a proteger o esmalte dental. Fonte: pxhere. Começamos com a seção dos usos para o fluoreto com o mais conhecido: servir como um componente de muitas pastas dentárias. Este não é o único uso onde o contraste entre sua molécula f pode ser visto2, extremamente venenoso e perigoso, e ânion f-, que dependendo de seu ambiente pode ser benéfico (embora às vezes não).
Quando comemos comida, especialmente doces, as bactérias os degradam aumentando a acidez de nossa saliva. Então, há um ponto em que o pH é suficiente para degradar e desmineralizar o esmalte dental; A hidroxiapatita vem "Down".
No entanto, neste processo, os íons f- interagir com ca2+ para formar uma matriz de fluorapatita; mais estável e duradouro que a hidroxiapatita. Ou pelo menos, este é o mecanismo proposto para explicar a ação do ânion de fluoreto nos dentes. É provável que seja mais complexo e que exista uma hidroxiapatita-fluorapatita dependente de pH.
Esses ânions f- Eles estão disponíveis em papas dentais em sais; como: naf, snf2 (O famoso Stine Fluoreide) e Napaf. No entanto, a concentração de f- Deve ser baixo (menor que 0,2%), pois, caso contrário, causa efeitos negativos no corpo.
Fluorização da água
Muito parecido com como com pastas dentárias, sais de flúor foram adicionados às fontes de água potável para combater a aparência de cárie naqueles que o bebem. A concentração ainda deve ser muito menor (0,7 ppm). No entanto, essa prática geralmente é desconfiada e controvérsia, como possíveis efeitos carcinogênicos foram atribuídos.
Agente oxidante
O gás f2 Ele se comporta como um agente oxidante muito forte. Isso faz com que muitos compostos organizem mais do que quando expostos a oxigênio e uma fonte de calor. É por isso que tem sido usado em misturas de combustível de foguetes, nas quais eles podem até substituir o ozônio.
Polímeros
Em muitos usos, as contribuições de fluoreto não são devidas a f2 ou f-, mas diretamente para seus átomos eletronegativos que fazem parte de um composto orgânico. Portanto, na essência de um link C-F.
Dependendo da estrutura, polímeros ou fibras com ligações C-F são geralmente hidrofóbicos, para que não se molhem ou resistam ao ataque do ácido fluorérico; Ou melhor ainda, eles podem ser excelentes isoladores elétricos e materiais úteis com os quais objetos como tubos e juntas são fabricados. Teflon e Navion são exemplos desses polímeros fluorados.
Farmacêuticos
A reatividade do fluoreto é chamada de uso para a síntese de compostos múltiplos de fluorina, orgânica ou inorgânica. Nos orgânicos, especificamente aqueles com efeitos farmacológicos, substituem um de seus heteroátomos por átomos F aumenta (positiva ou negativamente) sua ação em seu objetivo biológico.
É por isso que, na indústria farmacêutica, a modificação de alguns medicamentos está sempre em cima da mesa, adicionando átomos de flúor.
Muito semelhante ocorre com herbicidas e fungicidas. O flúor neles pode aumentar sua ação e eficácia em insetos e pragas de fungos.
Gravura de vidro
O ácido fluorérico, devido à sua agressividade com vidro e cerâmica, tem sido usada para gravar pedaços finos e delicados desses materiais; Geralmente destinado à fabricação de microcomponentes de computadores ou para lâmpadas elétricas.
Enriquecimento de urânio
Um dos usos mais relevantes do fluoreto elementar é ajudar a enriquecer o urânio como 235OU. Para fazer isso, os minerais de urânio se dissolvem no ácido fluorérico, produzindo UF4. Este fluoreto inorgânico reage com o f2, Para se transformar em uf6 (235Ufa6 e 238Ufa6).
Posteriormente, e através de uma centrifugação gasosa, o 235Ufa6 Se separa de 238Ufa6 e depois oxidado e armazenado como combustível nuclear.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Krämer Katrina. (2019). A estrutura de flúor congelada revistou após 50 anos. Sociedade Real de Química. Recuperado de: químicaworld.com
- Wikipedia. (2019). Flúor. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Flúor. Banco de dados PubChem. CID = 24524. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Dr. Doug Stewart. (2019). Fatos do elemento fluorino. Chemicool. Recuperado de: Chemicool.com
- BATUL NAFISA BAXAMUSA. (21 de fevereiro de 2018). Os usos surpreendentemente comuns do flúor altamente reativo. Recuperado de: sciencestruck.com
- Paola Opazo Sáez. (4 de fevereiro de 2019). Fluoreto em pasta de dente: é bom ou ruim para a saúde? Recuperado de: Nacionfarma.com
- Karl Christe e Stefan Schneider. (8 de maio de 2019). Fluorina: elemento químico. Encyclopædia britannica. Recuperado de: Britannica.com
- Lentech b.V. (2019). Tabela de período: oxigênio. Recuperado de: lentech.com
- Gagnon Steve. (s.F.). O elemento flúor. Jefferson Lab. Recuperado de: educação.Jlab.org
- A equipe de conteúdo médico e editorial da American Cancer Society. (28 de julho de 2015). Fluoretação de água e risco de câncer. Recuperado de: câncer.org
- « Características científicas exatas, o que você estuda, exemplos
- Sem história de metais, propriedades, grupos, usa »

