Estrutura de Nitruro de Boro (BN), propriedades, obtenção, uso
- 4716
- 1463
- Lonnie MacGyver
Ele Nitreto de boro É um sólido inorgânico formado pela união de um átomo de boro (b) com um átomo de nitrogênio (n). Sua fórmula química é BN. É um sólido branco muito resistente em altas temperaturas e é um bom driver de calor. É usado, por exemplo, para fabricar crosolos de laboratório.
Boro nituro (BN) é resistente a muitos ácidos, no entanto, tem alguma fraqueza aos ataques do ácido fluoreto e as bases fundidas. É um bom isolador de eletricidade.
 Estrutura de nitreto de boro (BN). AKERAMOP [domínio público]. Fonte: Wikimedia Commons.
Estrutura de nitreto de boro (BN). AKERAMOP [domínio público]. Fonte: Wikimedia Commons. É obtido em várias estruturas cristalinas, das quais as mais importantes são hexagonais e cúbicas. A estrutura hexagonal se assemelha a grafite e é escorregadia, por isso é usada como um lubrificante.
A estrutura cúbica é quase tão difícil quanto o diamante e é usado para fabricar ferramentas de corte e melhorar a dureza de outros materiais.
Com nitreto de boro, você pode fabricar tubos microscópicos (extremamente finos) chamados nanotubos, que possuem aplicações médicas, como transportar dentro do corpo e liberar medicamentos contra tumores de câncer.
[TOC]
Estrutura
Boro nituro (BN) é um composto em que os átomos de boro e nitrogênio estão ligados covalentemente a um link triplo.
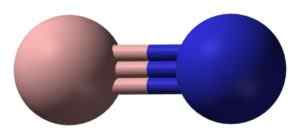 Uma molécula isolada de nitreto de boro tem um átomo de nitrogênio de nitrogênio unido por um link triplo. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
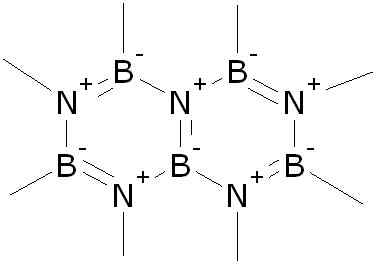
Uma molécula isolada de nitreto de boro tem um átomo de nitrogênio de nitrogênio unido por um link triplo. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Na fase sólida, o BN é formado por um número igual de átomos de boro e nitrogênio na forma de 6 membros dos membros.
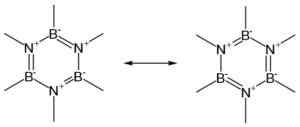 Estruturas de ressonância de um anel BN. Autor: Teachi. Fonte: Wikimedia Commons.
Estruturas de ressonância de um anel BN. Autor: Teachi. Fonte: Wikimedia Commons. O BN existe em quatro formas cristalinas: hexagonal (h-bn) semelhante à grafite, cúbica (c-bn) semelhante a diamante, rhomboédica (r-bn) e wurtzita (w-bn).
A estrutura do H-Bn é semelhante à da grafite, ou seja, possui aviões hexagonais que têm átomos de boro e nitrogênio que alternam.
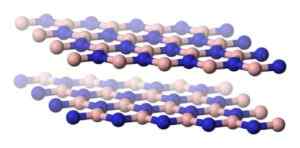 Estrutura na forma de planos separados de nitreto de boro hexagonal. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Estrutura na forma de planos separados de nitreto de boro hexagonal. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Entre os aviões H-BN, há uma grande distância que sugere que eles estão unidos apenas pelas forças de van der Waals, que são forças de atração muito fracas e os planos podem deslizar facilmente um no outro.
Pode servir você: solPor esse motivo, o h-bn é untuoso ao toque.
A estrutura do c-bn cúbico é semelhante ao diamante.
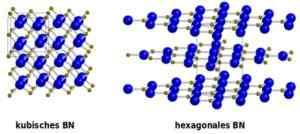 Comparação entre nituro cúbico (esquerda) e hexagonal (direita). De: Benutzer: Oddball, versão vetorial de Chris 論 [Domínio Público]. Fonte: Wikimedia Commons.
Comparação entre nituro cúbico (esquerda) e hexagonal (direita). De: Benutzer: Oddball, versão vetorial de Chris 論 [Domínio Público]. Fonte: Wikimedia Commons. Nomenclatura
Nitreto de boro
Propriedades
Estado físico
Sólido branco gorduroso ou escorregadio para tocar.
Peso molecular
24,82 g/mol
Ponto de fusão
Sublima a aproximadamente 3000 ° C.
Densidade
Bn hexagonal = 2,25 g/cm3
BN cúbico = 3,47 g/cm3
Solubilidade
Ligeiramente solúvel em álcool quente.
Propriedades quimicas
Devido à forte ligação entre nitrogênio e boro (vínculo triplo), o nitreto de boro tem alta resistência ao ataque químico e é muito estável.
É insolúvel em ácidos, como o ácido clorídrico HCl, o ácido nítrico HNO3 e ácido sulfúrico H2SW4. Mas é solúvel em bases fundidas, como hidróxido de lítio lioh, hidróxido de potássio koh e hidróxido de sódio NaOH.
Não reage com a maioria dos metais, vidro ou sais. Às vezes reage com ácido fosfórico H3Po4. Você pode resistir a oxidação em altas temperaturas. O BN é estável no ar, mas a água hidrolisa lentamente.
O BN é atacado pelo Fluorine F Gas2 e por HF ácido fluorhorérico.
Outras propriedades físicas
Possui alta condutividade térmica, alta estabilidade térmica e alta resistividade elétrica, ou seja, é um bom isolador de eletricidade. Tem uma área de alta superfície.
H-BN (BN hexagonal) é um sólido untuoso para tocar, semelhante à grafite.
Ao aquecer o H-Bn a alta temperatura e a pressão se torna a forma cúbica c-bn que é extremamente difícil. De acordo com algumas fontes, ele é capaz de arranhar o diamante.
Os materiais baseados em BN têm capacidade de sorção de poluentes inorgânicos (como íons de metais pesados) e poluentes orgânicos (como corantes e moléculas de drogas).
Sorción significa que interage com eles e pode adsorvê -los ou absorvê -los.
Obtenção
O pó H-BN é preparado por reação entre o bioxido de boro B2QUALQUER3 ou ácido bórico h3Bo3 Com amônia NH3 ou com uréia NH2(CO) NH2 Sob atmosfera de nitrogênio n2.
Pode atendê -lo: Mount Olympus (Marte)O BN também pode ser obtido reagindo boro com amônia a uma temperatura muito alta.
Outra maneira de prepará -lo é de Diborano B2H6 e amônia NH3 Usando um gás inerte e altas temperaturas (600-1080 ° C):
B2H6 + 2 NH3 → 2 bn + 6 h2
Formulários
O H-BN (hexagonal Boron Nituro) possui uma variedade de aplicações importantes com base em suas propriedades:
-Como lubrificante sólido
-Como aditivo para cosméticos
-Em isoladores elétricos de alta temperatura
-Em cadinhos e vasos de reação
-Em moldes e recipientes de evaporação
-Para armazenamento de hidrogênio
-Na catálise
-Para adsorver poluentes de águas residuais
Nituro de boro cúbico (C-BN) por sua dureza quase igual ao do diamante é usado:
-Em ferramentas de corte para usinar materiais ferrosos duros, como ligas de aço duro, ferro fundido e aços de ferramentas
-Para melhorar a dureza e a resistência ao desgaste de outros materiais duros, como certas cerâmicas para ferramentas de corte.
 Algumas ferramentas de corte podem conter o Boron Nitruro para exibir maior dureza. Autor: Michael Schwarzenberger. Fonte: Pixabay.
Algumas ferramentas de corte podem conter o Boron Nitruro para exibir maior dureza. Autor: Michael Schwarzenberger. Fonte: Pixabay. - Usos de filmes finos de BN
Eles são muito úteis na tecnologia de dispositivos semicondutores, que são componentes de equipamentos eletrônicos. Eles servem, por exemplo:
-Fabricar diodos planos; Diodos são dispositivos que permitem a circulação de eletricidade em um sentido
-Em diodos de memória de metal para semicondutores, como al-bn-sio2-Sim
-Em circuitos integrados como limitador de tensão
-Para aumentar a dureza de certos materiais
-Para proteger alguns materiais de oxidação
-Para aumentar a estabilidade química e o isolamento elétrico de muitos tipos de dispositivos
-No condensador de filme fino
 Alguns diodos e capacitores podem conter nitreto de boro. Autor: Sinisa Maric. Fonte: Pixabay.
Alguns diodos e capacitores podem conter nitreto de boro. Autor: Sinisa Maric. Fonte: Pixabay. - Usos de nanotubos BN
Os nanotubos são estruturas que no nível molecular são moldadas como tubos. São tubos tão pequenos que só podem ser vistos com microscópios especiais.
Abaixo estão algumas das características dos nanotubos BN:
-Eles têm uma alta hidrofobicidade, ou seja, repelem a água
-Eles têm alta resistência à oxidação e ao calor (a oxidação pode resistir a até 1000 ° C)
-Eles exibem uma alta capacidade de armazenamento de hidrogênio
-Eles absorvem a radiação
-Eles são muito bons isoladores de eletricidade
Pode servir a você: Termômetro de resistência: características, operação, usos-Eles têm alta condutividade térmica
-Sua excelente resistência a altas temperaturas oxidação significa que elas podem ser usadas para aumentar a estabilidade para a oxidação superficial.
-Devido à sua hidrofobicidade, eles podem ser usados para preparar superfícies super hidrofóbicas, ou seja, eles não têm afinidade por água e água não os penetra.
-Os nanotubos BN melhoram as propriedades de certos materiais, por exemplo, tem sido usado para aumentar a dureza e a resistência à fratura de vidro.
 Nitubos de Nitruro de Boron observado com um microscópio. Keun seu Kim et al. [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)]. Fonte: Wikimedia Commons.
Nitubos de Nitruro de Boron observado com um microscópio. Keun seu Kim et al. [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)]. Fonte: Wikimedia Commons. Em aplicações médicas
Os nanotubos BN foram testados como portadores de medicina do câncer, como doxorrubicina. Certas composições com esses materiais aumentaram a eficiência da quimioterapia com o referido medicamento.
Em várias experiências, foi demonstrado que os nanotubos BN têm o potencial de transportar novos medicamentos e liberá -los adequadamente.
O uso de nanotubos BN em biomateriais poliméricos foi investigado para aumentar sua dureza, degradação e velocidade de durabilidade. São materiais que são usados, por exemplo, em implantes ortopédicos.
Como sensores
Nanotubos BN foram usados para construir novos dispositivos para detectar umidade, dióxido de carbono2 e para diagnósticos clínicos. Esses sensores demonstraram uma resposta rápida e um curto tempo de recuperação.
Possível toxicidade dos materiais BN
Há alguma preocupação com os possíveis efeitos tóxicos dos nanotubos BN. Não há consenso claro sobre sua citotoxicidade, porque alguns estudos indicam que são tóxicos para as células, enquanto outros indicam o oposto.
Isso se deve à sua hidrofobicidade ou insolubilidade na água, pois dificulta a realização de estudos em materiais biológicos.
Alguns pesquisadores cobriram a superfície dos nanotubos BN com outros compostos que favorecem sua solubilidade na água, mas isso adicionou maior incerteza nas experiências.
Embora a maioria dos estudos indique que seu nível de toxicidade é baixo, estima -se que pesquisas mais precisas sejam realizadas.
Referências
- Xiong, J. et al. (2020). Adsorvente de nitreto de boro hexagonal: síntese, alfaiataria de desempenho e aplicações. Journal of Energy Chemistry 40 (2020) 99-111. Recuperado do leitor.Elsevier.com.
- Mukasyan, a.S. (2017). Nitreto de boro. Na enciclopédia concisa da síntese de alta temperatura autopropagadora. Recuperado de cientedirect.com.
- Kalay, s. et al. (2015). Síntese de nanotubos de nitreto de boro e suas aplicações. Beilstein J. Nanotechnol. 2015, 6, 84-102. NCBI se recuperou.Nlm.NIH.Gov.
- Arya, s.P.S. (1988). Preparação, propriedades e aplicações de filmes finos de nitreto de boro. Film Solid Films, 157 (1988) 267-282. Recuperado de cientedirect.com.
- Zhang, j. et al. (2014). Compósitos de matriz cerâmica contendo nitreto de boro de boro para ferramentas de corte. Em avanços em compósitos de matriz cerâmica. Recuperado de cientedirect.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Suanarsan, v. (2017). Materiais para ambiente químico hostil. Em materiais em condições extremas. Recuperado de cientedirect.com
- Dean, J.PARA. (Editor) (1973). Manual de Química de Lange. McGraw-Hill Company.
- Mahan, b.H. (1968). Química da Universidade. Fundo Educacional Inter -Americano, S.PARA.

