Estrutura de fluoreto de cálcio (CAF2), propriedades, usos

- 4791
- 693
- Mr. Reginald Lindgren
Ele fluoreto de cálcio É um sólido inorgânico formado por um átomo de cálcio (CA) e dois átomos de flúor (F). Sua fórmula química é CAF2 E é um sólido cinza cristalino.
Na natureza, é encontrado no minério de fluorita ou no fluore de respingo. Existe naturalmente em ossos e dentes. O Fluorite Mineral é a principal fonte usada para obter outros compostos de flúor.
 Fluoreto de cálcio da CAF2 sólido. W: Usuário: Walkerma em junho de 2005. Fonte: Wikimedia Commons.
Fluoreto de cálcio da CAF2 sólido. W: Usuário: Walkerma em junho de 2005. Fonte: Wikimedia Commons. Além do café2 É usado para a prevenção de cárie nos dentes, por isso é adicionado aos materiais usados pelos dentistas para curá -los. De fato, o fluoreto de cálcio também é adicionado à água potável (água que pode ser bebida) para que a população se beneficie ao ingerir e escovar os dentes.
Caf2 É usado em grandes cristais em equipamentos ópticos e câmeras. Também é usado em pequenos dispositivos que servem para detectar o quanto uma pessoa foi exposta à radioatividade.
[TOC]
Estrutura
Fluoreto de cálcio da CAF2 É um composto iônico formado por um cátion de cálcio da CA2+ e duas áreas de fluoreto-. No entanto, algumas fontes de informação indicam que seus links têm um certo caráter covalente.
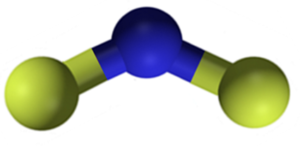 Estrutura de fluoreto de cálcio CAF2. Azul: cálcio; Fluorina amarela. Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Estrutura de fluoreto de cálcio CAF2. Azul: cálcio; Fluorina amarela. Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Nomenclatura
Fluoreto de cálcio
Propriedades
Estado físico
Colorir sólido a branco acinzentado com estrutura cristalina cúbica.
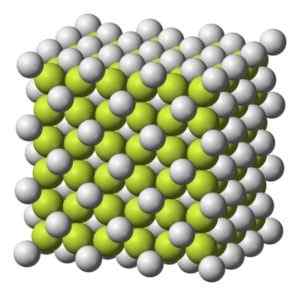 Estrutura cristalina cúbica do café2. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Estrutura cristalina cúbica do café2. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Peso molecular
78,07 g/mol
Ponto de fusão
1418 ºC
Ponto de ebulição
2533 ºC
Densidade
3,18 g/cm3 A 20 ° C.
Índice de refração
1.4328
Solubilidade
É insolúvel em água a 20 ° C. Quase insolúvel a 25 ° C: 0,002 g/100 ml de água. Ligeiramente solúvel em ácido.
Propriedades quimicas
Suas propriedades oxidantes ou redutoras são muito fracas, no entanto, essas reações podem ocorrer. Embora, geralmente, em muito poucos casos.
É inerte para compostos químicos orgânicos e muitos ácidos, incluindo ácido fluorérico HF. Dissolve lentamente em ácido nítrico3.
Pode servir a você: Millikan Experiment: Procedimento, Explicação, ImportânciaNão é inflamável. Não reage rapidamente com o ar ou a água.
Devido à sua pouca afinidade pela água, embora esteja exposta a uma alta porcentagem de umidade, não a afeta nem por um mês à temperatura ambiente normal.
Na presença de umidade, as paredes de seus cristais são lentamente dissolvidas em temperaturas acima de 600 ° C. Em ambientes secos, pode ser usado até cerca de 1000 ° C sem afetada consideravelmente.
Presença na natureza
Fluoreto de cálcio da CAF2 É encontrado naturalmente em minério de fluorita ou fluoreto de respingo.
Embora o café2 Puro é incolor, o mineral de fluorita é frequentemente colorido pela presença de elétrons presos nos "orifícios" da estrutura cristalina.
Este mineral é muito apreciado por seu brilho vítreo e variedade de cores (roxo, azul, verde, amarelo, incolor, marrom, rosa, preto e laranja avermelhado). Diz -se que é "o mineral mais colorido do mundo".
 Fluorito de uma mina na França. Toulouse Muséum [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Fluorito de uma mina na França. Toulouse Muséum [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Fluorite (cristais azuis) do Museu Natural de Milão. Giovanni Dall'orto [CC BY-SA 2.5 It (https: // CreativeCommons.Org/licenças/BY-SA/2.5/it/ação.em)]. Fonte: Wikimedia Commons.
Fluorite (cristais azuis) do Museu Natural de Milão. Giovanni Dall'orto [CC BY-SA 2.5 It (https: // CreativeCommons.Org/licenças/BY-SA/2.5/it/ação.em)]. Fonte: Wikimedia Commons. Fluorito de uma mina na Inglaterra. Didier Descuens [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Fluorito de uma mina na Inglaterra. Didier Descuens [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Fluorito de uma mina na França. Didier Descuens [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Fluorito de uma mina na França. Didier Descuens [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
 Fluorito de uma mina nos EUA. Autor: Oliveira Jurema. Fonte: Wikimedia Commons.
Fluorito de uma mina nos EUA. Autor: Oliveira Jurema. Fonte: Wikimedia Commons. O fluoreto de cálcio também é encontrado em ossos em quantidades entre 0,2 e 0,65%, e também no esmalte dos dentes em 0,33-0,59%.
Formulários
- Na obtenção de compostos de flúor
Fluorita Caf2 É a fonte básica ou majoritária de fluoreto em todo o mundo. É a matéria -prima para preparar quase todos os compostos de flúor.
O mais importante deles é o ácido fluoréricico de HF, do qual os outros compostos fluidos são preparados. O íon fluoreto f- É liberado do mineral por reação disso com ácido sulfúrico concentrado H2SW4:
Pode atendê -lo: isomeriaCaf2 (sólido) + h2SW4 (líquido) → caso4 (sólido) + 2 hf (gás)
- Nos cuidados dos dentes
Fluoreto de cálcio da CAF2 É um agente para prevenção de cárie. É usado para fluorizar águas potáveis (águas que podem ser bebidas) com esse objetivo.
Além disso, as baixas concentrações de fluoreto f- (da ordem de 0,1 peças por milhão) que são usadas em pastas e enxaguatórios bucais dentários demonstraram ter um efeito positivo profundo no atento preventivo da cárie.
 O fluoreto de cálcio ajuda na prevenção de cárie. Autor: Annalize Batista. Fonte: Pixabay.
O fluoreto de cálcio ajuda na prevenção de cárie. Autor: Annalize Batista. Fonte: Pixabay. Nanopartículas de CAF2 mais efetivo
Embora os fluoretos sejam usados em pastas dentárias e enxaguar, a baixa concentração de cálcio (CA) na saliva faz com que os depósitos de café não se formem2 nos dentes da maneira mais eficaz possível.
É por isso que uma maneira de obter pó de café foi criada2 como nanopartículas.
Para isso, um secador é usado por Rocío (do inglês Spray secador) Onde duas soluções (uma do hidróxido de cálcio CA (OH)2 e um de fluoreto de amônio NH4F) Eles se misturam enquanto são pulverizados em uma câmera com fluxo de ar quente.
Então a seguinte reação ocorre:
CA (OH)2 + NH4F → CAF2 (sólido) + NH4Oh
O NH4Oh volatiliza como NH3 e h2O e as nanopartículas de café permanecem2.
Eles têm alta reatividade e maior solubilidade, o que os torna mais eficazes para a seineralização dos dentes e como anticários.
- Em lente para equipamentos ópticos
O fluoreto de cálcio é usado para construir elementos ópticos, como prismas e espectrofotômetros de luz infravermelha e ultravioleta (UV).
Esses dispositivos permitem medir a quantidade de luz absorvida por um material quando passa por ele.
Caf2 É transparente nessas regiões do espectro da luz, possui um índice de refração extremamente baixo e permite obter uma resolução mais eficiente do que a de NaCl no intervalo de 1500-4000 cm-1.
Pode atendê -lo: paramagnetismoGraças à sua estabilidade química pode suportar condições adversas para que os elementos ópticos do CAF2 Eles não são atacados. Também tem uma alta dureza.
Em câmeras
Alguns fabricantes de câmeras usam lentes de café2 Artificial cristalizado para reduzir a dispersão da luz e alcançar uma excelente correção de cores distorção.
 Algumas câmeras têm lentes de fluoreto de cálcio CAF2 Para reduzir a distorção de cores. Bill Ebbesen [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons.
Algumas câmeras têm lentes de fluoreto de cálcio CAF2 Para reduzir a distorção de cores. Bill Ebbesen [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons. - Na indústria metalúrgica
Caf2 É usado como agente fundador na indústria metalúrgica, porque é uma fonte de cálcio insolúvel em água e, portanto, eficaz em aplicações sensíveis a oxigênio.
É usado para derreter e processar ferro e aço. Isso se baseia no fato de ter um ponto de fusão semelhante ao de ferro e também que pode dissolver óxidos e metais.
- Em detectores de radioatividade ou radiação perigosa
Caf2 É um material termoluminescente. Isso significa que ele pode absorver a radiação nos elétrons de sua estrutura cristalina e depois quando é aquecido para liberá -lo na forma de luz.
Esta luz emitida pode ser medida por um sinal elétrico. Este sinal é proporcional à quantidade de radiação recebida pelo material. Significa que quanto maior a quantidade de radiação, maior a quantidade de luz que será emitida mais tarde quando aquecida.
Portanto, o CAF2 É usado nos dois two -timéricos pessoais, que são usados por pessoas expostas a radiação perigosa e você deseja saber quanta radiação eles receberam em um período de tempo.
- Outros usos
- É usado como catalisador em reações químicas de desidratação e desidrogenação para a síntese de compostos orgânicos.
- É usado em eletrodos alcalinos de soldagem. Uma soldagem mais forte é obtida do que com eletrodos ácidos. Esses eletrodos são úteis na fabricação de navios e recipientes de aço de alta pressão.
- Como suplemento alimentar em quantidades extremamente baixas (ppm ou peças por milhão).
 Soldagem do homem. Eletrodos com café fluoreto de cálcio2 Eles formam soldas mais fortes. William m. Placa Jr. [Domínio público]. Fonte: Wikimedia Commons.
Soldagem do homem. Eletrodos com café fluoreto de cálcio2 Eles formam soldas mais fortes. William m. Placa Jr. [Domínio público]. Fonte: Wikimedia Commons. Referências
- Pirdradian, m. e hooshmand, t. (2019). Remineralização e capacidades antibacterianas de nanocompósitos dentários à base de resina. Síntese e caracterização do fluoreto de cálcio (CAF2). Em aplicações de materiais nanocompósitos em odontologia. Recuperado de cientedirect.com.
- OU.S. Biblioteca Nacional de Medicina. (2019). Fluoreto Cálcio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Weman, k. (2012). Soldagem manual de arco de metal (MMA) com eletrodos revestidos. No Manual de Processos de Soldagem (segunda edição). Recuperado de cientedirect.com.
- Hanning, m. e hanning, c. (2013). Nanobiomateriais em odontologia preventiva. Cálcio nanoesado de fluoreto. Em nanobiomateriais em odontologia clínica. Recuperado de cientedirect.com.
- ROPP, r.C. (2013). Grupo 17 (H, F, Cl, Br, I) Compostos Alcalinos da Terra. Fluoreto Cálcio. Na enciclopédia dos compostos da Terra Alcalina. Recuperado de cientedirect.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Valkovic, v. (2000). Medições de radioatividade. Na radioatividade no ambiente. Detectores temoluminescentes (TLDs). Recuperado de cientedirect.com.
- « Estrutura de Nitruro de Boro (BN), propriedades, obtenção, uso
- Estrutura de óxido de silício (SiO2), propriedades, usos, obtenção »

