Estrutura de óxido de silício (SiO2), propriedades, usos, obtenção

- 819
- 200
- Mr. Reginald Lindgren
Ele óxido de silício É um sólido inorgânico formado pela união de um átomo de silício e dois oxigênio. Sua fórmula química é Sio2. Este composto natural também é chamado de silício ou dióxido de silício.
O SiO2 É o mineral mais abundante da crosta terrestre, já que a areia é composta por sílica. De acordo com sua estrutura, a sílica pode ser cristalina ou amorfa. É insolúvel em água, mas se dissolve em álcalis e em ácido fluorérico HF.
 A areia é uma fonte de dióxido de silício Sio2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
A areia é uma fonte de dióxido de silício Sio2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. O SiO2 Também está presente na estrutura de certas plantas, bactérias e fungos. Também em esqueletos de organismos marinhos. Além da areia, também existem outros tipos de pedras que são sílica.
Sílica tem um uso muito difundido cumprindo uma variedade de funções. O uso mais difundido é como material de filtragem de líquidos, como óleos e produtos petrolíferos, bebidas como cerveja e vinho, bem como sucos de frutas.
Mas tem muitas outras aplicações. Um dos mais úteis e importantes é a fabricação de vidro bioativo, que permite “andaimes” onde as células ósseas crescem para produzir peças ósseas ausentes devido a acidente ou doença.
[TOC]
Estrutura
Silicio sio dióxido2 É uma molécula de três átomos, na qual o átomo de silício está ligado a dois átomos de oxigênio com ligações covalentes.
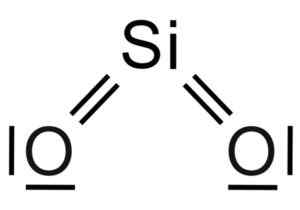 Estrutura química da molécula de SiO2. Grasso Luigi [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Estrutura química da molécula de SiO2. Grasso Luigi [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. A unidade estrutural de sílica sólida como tal é um tetraedro onde um átomo de silício é cercado por 4 átomos de oxigênio.
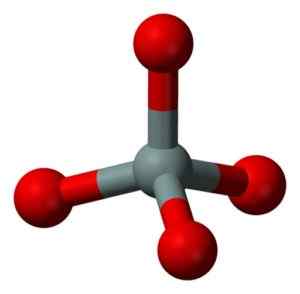 Unidade estrutural de sílica sólida: cinza = silício, vermelho = oxigênio. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Unidade estrutural de sílica sólida: cinza = silício, vermelho = oxigênio. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Os tetraedros se ligam um ao outro compartilhando os átomos de oxigênio de seus vértices contíguos.
É por isso que um átomo de silício compartilha pela metade de cada um dos 4 átomos de oxigênio e isso explica a proporção no composto de 1 átomo de silício em 2 átomos de oxigênio (SIO2).
 Tetraedra compartilham oxigênio no SIO2. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Tetraedra compartilham oxigênio no SIO2. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Compostos sio2 Eles são divididos em dois grupos: sílica cristalina e sílica amorfa.
Compostos de sílica cristalina têm estruturas com padrões repetitivos de silício e oxigênio.
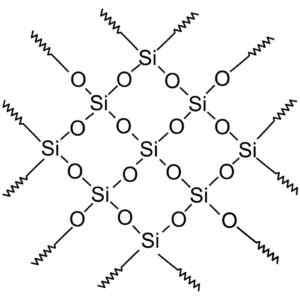 Sílica cristalina tem unidades repetitivas. Wersję rastrową wykonał użytkownik polskiego projektu wikipedii: polyimerek, zwektoryzował: krzysztof zajączkowski [gfdl (http: // ww.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons.
Sílica cristalina tem unidades repetitivas. Wersję rastrową wykonał użytkownik polskiego projektu wikipedii: polyimerek, zwektoryzował: krzysztof zajączkowski [gfdl (http: // ww.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons. Todo o cristal de sílica pode ser considerado como uma molécula gigante onde a rede cristalina é muito forte. O tetraedro pode ser ligado de várias maneiras, dando origem a várias formas cristalinas.
Pode atendê -lo: Redes Bravais: conceito, características, exemplos, exercíciosNa sílica amorfa, as estruturas estão ligadas aleatoriamente, sem seguir um padrão regular entre as moléculas e estas estão em um relacionamento espacial diferente um entre si.
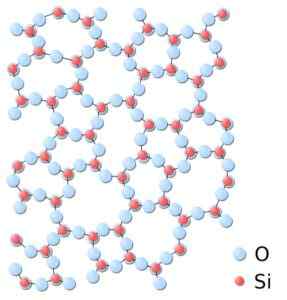 Na sílica amorfa, os sindicatos não são repetitivos ou uniformes. Sílica.Svg: *sílica.JPG: In: Usuário: JDrewittDeriveVative Trabalho: Matt [Domínio Público]. Fonte: Wikimedia Commons.
Na sílica amorfa, os sindicatos não são repetitivos ou uniformes. Sílica.Svg: *sílica.JPG: In: Usuário: JDrewittDeriveVative Trabalho: Matt [Domínio Público]. Fonte: Wikimedia Commons. Nomenclatura
-Óxido de silício
-Dióxido de silício
-Sílica
-Quartzo
-Tridimita
-Cristobalita
-Dioxosilano
Propriedades
Estado físico
Cor incolor a cinza.
 Amostra SIO2 puro. LHCHEM [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Amostra SIO2 puro. LHCHEM [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Peso molecular
60.084 g/mol
Ponto de fusão
1713 ºC
Ponto de ebulição
2230 ºC
Densidade
2,17-2,32 g/cm3
Solubilidade
Insolúvel em água. A sílica amorfa é solúvel em álcalis, especialmente se for dividido finamente. Solúvel em ácido fluorhorrérmico hf.
A sílica amorfa é menos hidrofílica, ou seja, menos relacionada à água do que o cristalino.
Propriedades quimicas
O SiO2 o sílica é essencialmente inerte para a maioria das substâncias, é muito pouco reativo.
Resiste ao ataque do cloro cl2, Bromo Br2, Hidrogênio h2 e da maioria dos ácidos à temperatura ambiente ou um pouco mais alta. É atacado pelo Fluorine F2, Ácido fluorhorrérico HF e álcalis, como carbonato de sódio2Co3.
O SiO2 Pode ser combinado com elementos de metal e óxidos para formar silicatos. Se a sílica derreter com carbonatos de metal alcalino a aproximadamente 1300 ° C, os silicatos alcalinos são obtidos e CO2.
Não é combustível. Tem baixa condutividade térmica.
Presença na natureza
A principal fonte de sílica na natureza é areia.
O SiO2 o sílica está na forma de três variedades cristalinas: quartzo (o mais estável), tridimita e Cristobalita. Amorphant para sílica é a agata, a jaspe e a ónice. A opala é uma sílica hidratada amorfa.
Há também a sílica biogênica de som, ou seja, a gerada por organismos vivos. Fontes desse tipo de sílica são bactérias, fungos, diatomáceas, esponjas do mar e plantas.
As partes brilhantes e difíceis do bambu e da palha contêm sílica, e os esqueletos de alguns organismos marinhos também têm uma grande proporção de sílica; No entanto, os mais importantes são os diatomadores.
Terras de diatomea são produtos geológicos de organismos unicelulares deteriorados (algas).
Pode atendê -lo: poeira cósmicaOutros tipos de sílica natural
Na natureza, também existem as seguintes variedades:
- Silicanos vítreo que são vidro vulcânico
- Os Milleritas que são vidro natural produzidos pela fusão de material silicioso sob o impacto dos meteoritos
- A sílica fundida que é sílica aquecida na fase líquida e resfriada sem permitir um cristalico
Obtenção
A sílica de arenas é obtida diretamente das pedreiras.
 Pedreia de arena na Califórnia. Ruff Tux Cream Puff [CC0]. Fonte: Wikimedia Commons.
Pedreia de arena na Califórnia. Ruff Tux Cream Puff [CC0]. Fonte: Wikimedia Commons. A diatomita ou diatomáceas também são obtidos dessa maneira, usando escavadeiras e equipamentos semelhantes.
A sílica amorfa é preparada com base em soluções aquosas de silicato de metal alcalino (como Na) por neutralização com ácido, como o ácido sulfúrico H2SW4, Ácido clorídrico HCl ou dióxido de carbono2.
Se o pH final da solução for neutro ou alcalino, a sílica precipitada será obtida. Se o pH for ácido, a sílica em gel é obtida.
A sílica pirogênica é preparada pela combustão de um composto volátil de silício, geralmente tetracloreto de silício Sicl4. A sílica precipitada é obtida de uma solução aquosa de silicatos aos quais o ácido é adicionado.
Sílica coloidal é uma dispersão estável de partículas coloidais de sílica amorfas em uma solução aquosa.
Formulários
Em várias aplicações
Sílica ou Sio2 Possui uma grande variedade de funções, por exemplo, serve como abrasivo, absorvente, antiapelmazante, recheado, opacificando e favorecer a suspensão de outras substâncias, entre muitos outros modos de emprego.
É usado por exemplo:
-Em vidro, cerâmica, refratária, abrasiva e manufatura de vidro solúvel
-Descoloração e purificação de óleos e produtos petrolíferos
-Em moldes para fundição
-Como antiapelmazante de pós de todos os tipos
-Como antispumante
-Para filtrar líquidos como solventes de lavagem a seco, a água das piscinas e as águas residuais municipais e industriais
-Na fabricação de isoladores de calor, tijolos à prova de fogo e materiais de embalagem resistentes a fogo e ácidos
-Como preencher a fabricação de papéis e cartões, para torná -los mais resistentes
-Como cheio de pinturas para melhorar seu fluxo e cor
-Em materiais para polimento de metal e madeira, como lhes dão abrasividade
-Em laboratórios de análise química em cromatografia e como absorvente
-Como antiapelmazante de inseticida e fórmulas agroquímicas, para ajudar a moer pesticidal e como transportador do composto ativo
-Como suporte de catalisador
-Como recheio para reforçar borracha e borrachas sintéticas
Pode atendê -lo: ondas longitudinais: características, diferenças, exemplos-Como um transportador de fluidos em alimentos animais
-Em tintas impressas
-Como dessecante e adsorvente, na forma de sílica gel
-Como aditivo em cimento
-Como areia de estimação
-Em isoladores de microeletrônicos
-Nos interruptores termopticos
 Gel de sílica. Kenpei [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Fonte: Wikimedia Commons.
Gel de sílica. Kenpei [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Fonte: Wikimedia Commons. Na indústria de alimentos
Uma sílica amorfa é incorporada a uma variedade de produtos alimentícios como um ingrediente direto multifuncional em vários tipos de alimentos. Você não deve exceder 2% da comida acabada.
Por exemplo, serve como antiapelmazante (para impedir que certos alimentos grudem), como um estabilizador na produção de cerveja, como um antiprecipitador, para filtrar vinho, cerveja e sucos de frutas ou vegetais.
 Equipe para filtragem de vinho com diatomáceas (SIO2). Fabio Ingroso [CC por 2.0 (https: // CreativeCommons.Org/licenças/por/2.0)]. Fonte: Wikimedia Commons.
Equipe para filtragem de vinho com diatomáceas (SIO2). Fabio Ingroso [CC por 2.0 (https: // CreativeCommons.Org/licenças/por/2.0)]. Fonte: Wikimedia Commons. Ele atua como um líquido absorvente em alguns alimentos e componente de microcápsulas para aromatizar óleos.
Além do SIO2 Amorfo é aplicado através de um processo especial na superfície dos plásticos dos artigos para embalar alimentos, atuando como uma barreira.
Na indústria farmacêutica
É adicionado como um agente antiapelmazante, espessamento, gelificação e excipiente, isto é, como assistente de moldar vários medicamentos e vitaminas.
Na indústria de cosméticos e cuidados pessoais
É usado em uma infinidade de produtos: em pós faciais, sombras, delineadores de olhos, batons, colorir, abrigos de maquiagem, talcos, pós de pés, corantes de cabelo e alvejante e alvejante.
Também em óleos e sais de banho, banhos de espuma, mãos e creme para o corpo.
Também em cremes de hidratação noturna, brilho e tinta de unhas.
Em aplicações terapêuticas
O SiO2 Está presente no vidro bioativo ou biovidrios cuja principal característica é que eles podem reagir quimicamente com o ambiente biológico que os rodeia, formando um vínculo forte e durável com o tecido vivo.
Esse tipo de material serve para fazer substitutos ósseos, como os do rosto, como "andaimes" nos quais as células ósseas crescerão. Eles demonstraram boa biocompatibilidade com ossos e tecidos moles.
Esses biovidrios permitirão recuperar ossos do rosto para pessoas que os perderam por acidente ou doença.
Riscos
Partículas de sílica muito finas podem ser suspensas no ar e formar pós não explosivos. Mas essa poeira pode irritar a pele e os olhos. Sua inalação causa irritação do trato respiratório.
Além disso, a inalação de pó de sílica produz danos a longo prazo dos pulmões, chamados de silicose.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Dióxido de silício. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Da Silva, M.R. et al. (2017). Técnicas de extração verde. Sorbnts baseados em sílica. Na compreensão da química analítica. Recuperado de cientedirect.com.
- Ylänen, h. (editor). (2018). Óculos bioativos: materiais, propriedades e aplicações (segunda edição). Elsevier. Recuperado de livros.Google.co.ir.
- Windholz, m. et al. (Editores) (1983) O índice Merck. Uma enciclopédia de produtos químicos, drarugs e biológicos. Décima edição. Merck & co., Inc.
- Mäkinen, J. E suni, t. (2015). As bolachas Soi de filme grosso. No Manual de Materiais e Tecnologias MEMS baseadas em silício (segunda edição). Recuperado de cientedirect.com.
- Sirleto, l. et al. (2010). Interruptores termo-ópticos. Nanocristais de silício. Recuperado de cientedirect.com.
- « Estrutura de fluoreto de cálcio (CAF2), propriedades, usos
- 275 piropos para homens românticos e sexy »

