Estrutura de nitrobenzeno (C6H5NO2), propriedades, usos, riscos

- 1198
- 329
- Terrell Stokes
Ele nitrobenzeno É um composto orgânico aromático formado por um anel benzênico C6H5- E um grupo nitro -não2. Sua fórmula química é C6H5NÃO2. É um líquido oleoso amarelo colorido ou pálido, com cheiro de amêndoas amargas ou sapatos para sapatos.
O nitobenzeno é um composto muito útil na indústria química porque permite obter uma série de substâncias químicas que têm usos variados. Isso ocorre porque pode estar sujeito a vários tipos de reações.
 Nitrobenceno, c6H5-NÃO2. Autor: Marilú Stea.
Nitrobenceno, c6H5-NÃO2. Autor: Marilú Stea. Entre as reações químicas importantes estão a nitração (o que permite adicionar mais grupos -não2 para a molécula) e a redução (o oposto da oxidação como os dois átomos de oxigênio do grupo nitro -no são eliminados2 e são substituídos por hidrogênios).
Com nitrobenceno, você pode se preparar, por exemplo, anilina e para-acetaminofenol. Este último é o bem conhecido acetaminofeno que é um analgésico antipirético (medicação de febre) e um analgésico mole (medicamento para dor menor).
O nitobenzeno deve ser manipulado com cautela porque é irritante e tóxico, pode causar um tipo de anemia, entre vários sintomas, e acredita -se que possa causar câncer. Também é prejudicial ao meio ambiente.
[TOC]
Estrutura
O nitrobenzeno c6H5-NÃO2 É uma molécula plana formada por um anel benzênico C6H5- ao qual um grupo nitro está ligado -não2. Sua molécula é plana porque há uma interação eletrônica entre o grupo nitro -não2 e o anel benzeno.
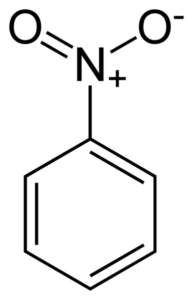 Estrutura plana da molécula de nitrobenzeno. Os elétrons dos links de anel duplo Bondyan tendem a interagir com o grupo nitro -não2. Autor: Benjah-BMM27. Fonte: Wikimedia Commons.
Estrutura plana da molécula de nitrobenzeno. Os elétrons dos links de anel duplo Bondyan tendem a interagir com o grupo nitro -não2. Autor: Benjah-BMM27. Fonte: Wikimedia Commons. O grupo nitro -não2 tende a atrair os elétrons do anel benzênico C6H5-.
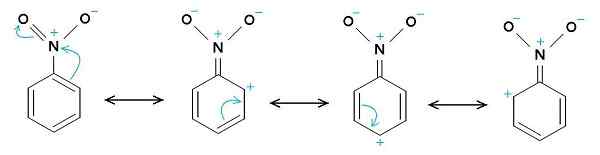 Estruturas de ressonância de nitrobenzeno. O anel benzeno tende a ter uma carga positiva, enquanto o grupo nitro -NO2 tende a ter uma carga negativa. O uploader original era Samuele Madini na Wikipedia italiana. [Domínio público]. Fonte: Wikimedia Commons.
Estruturas de ressonância de nitrobenzeno. O anel benzeno tende a ter uma carga positiva, enquanto o grupo nitro -NO2 tende a ter uma carga negativa. O uploader original era Samuele Madini na Wikipedia italiana. [Domínio público]. Fonte: Wikimedia Commons. É por isso que a molécula tem um lado um pouco mais negativo (onde o oxigênio de -No é2) e um lado um pouco mais positivo (o anel benzeno).
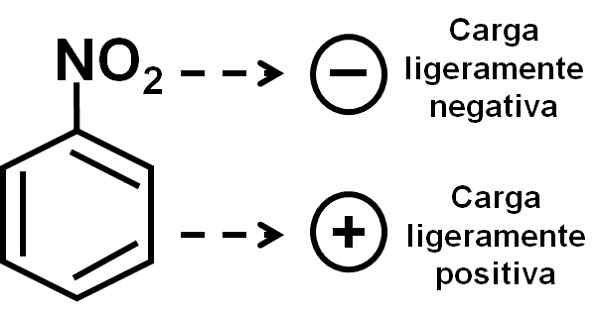 O oxigênio do grupo nitro tem carga ligeiramente negativa em comparação com o anel benzênico. Autor: Marilú Stea.
O oxigênio do grupo nitro tem carga ligeiramente negativa em comparação com o anel benzênico. Autor: Marilú Stea. Nomenclatura
- Nitrobenzeno.
- Nitrobenze.
- Nitrobenzol.
- Petróleo ou essência de Mirbano ou Mirbana (termo desuso).
Propriedades
Estado físico
Líquido oleoso colorido para amarelo pálido.
Peso molecular
123,11 g/mol.
Ponto de fusão
5.7 ºC.
Ponto de ebulição
211 ºC.
Pode atendê -lo: cloreto de cobalto (cocl2 (: estrutura, nomenclatura, propriedadesPonto de inflamação
88 ºC (método de copo fechado).
Temperatura de auto -dirigir
480 ° C.
Densidade
1.2037 g/cm3 A 20 ºC.
Solubilidade
Pequena água solúvel: 0,19 g/100 g de água a 20 ° C. Completamente miscível com álcool, benzeno e éter de mergulho.
Propriedades quimicas
O nitrobenceno é estável até aproximadamente 450 ° C de temperatura em que começa a decompor a formação (na ausência de oxigênio) não, não2, Benzeno, bifenil, anilina, dibenzofurano e naftaleno.
Entre as reações importantes do nitrobenceno estão a redução, nitração, halogenação e sulfonação.
A nitração de nitrobenzeno produz inicialmente meta-nitrobenzeno e com um longo tempo de reação, 1,3,5-nitobenzeno é obtido.
O bromo reagido ou cloro com nitrobenzeno na presença de um catalisador apropriado é obtido 3-bromo-nitrobenzeno (meta-bromonitrobenceno) ou 3-Cllor-nitrobenzeno (meta-cloronitrobenzeno).
Um exemplo de redução é que, ao lidar com a lata (SN) no ácido clorídrico (HCl), os meta-halogenonitobenzenos são obtidos pela meta-halogoanilina.
A sulfonação do nitrobenzeno é realizada com ácido sulfúrico de fumar a 70-80 ° C e o produto é meta-nitrobenzeulfônico meta-nitrobenze. Isso pode ser reduzido com ferro e hcl para dar ácido metanil.
Formação do dimmer
Em uma solução benzeno C6H6 As moléculas de nitrobenceno estão associadas entre si pares de diâmetro ou moléculas. Nesses pares, uma das moléculas está em uma posição invertida em relação ao outro.
A formação de diâmetros de nitrobenzeno com moléculas um em uma posição invertida em relação ao outro se deve ao fato de que cada um deles tem um lado um pouco mais positivo e um lado oposto com carga ligeiramente mais negativa.
No dímero, o lado com carga um pouco mais positiva de uma das moléculas está possivelmente localizada perto da carga ligeiramente negativa da outra molécula, porque as cargas opostas são atraídas e, assim, acontece com os outros dois lados.
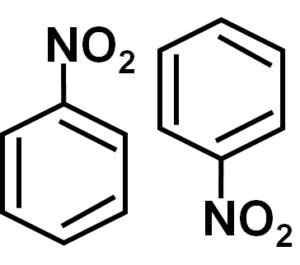 Número de nitrobenceno, ou seja, duas moléculas que tendem a estar juntas em alguns solventes. Autor: Marilú Stea.
Número de nitrobenceno, ou seja, duas moléculas que tendem a estar juntas em alguns solventes. Autor: Marilú Stea. Outras propriedades
Apresenta um cheiro semelhante às amêndoas ou ao polimento para sapatos. Abaixando sua solidifica a temperatura na forma de cristais amarelos esverdeados.
Obtenção
Você consegue tratar o benzeno c6H6 Com uma mistura de ácido nítrico hno3 e ácido sulfúrico H2SW4. O processo é chamado de nitração e envolve a formação do íon nitronium não2+ Graças à presença de ácido sulfúrico H2SW4.
- Nitronio ion no2+:
Hno3 + 2 h2SW4 ⇔ h3QUALQUER+ + 2 HSO4- + NÃO2+ (Nitronio Ion)
- O íon nitronio ataca o benzeno:
Pode servir a você: erro sistemático: como calculá -lo, em química, em física, exemplosC6H6 + NÃO2+ → c6H6NÃO2+
- O nitrobenceno é formado:
C6H6NÃO2+ + HSO4- → c6H5NÃO2 + H2SW4
Em resumo:
C6H6 + Hno3 → c6H5NÃO2 + H2QUALQUER
A reação de nitração do benzeno é muito exotérmica, ou seja, muito calor é gerado, por isso é muito perigoso.
Formulários
Ao obter anilina e acetaminofeno
O nitrobenceno é usado principalmente para sintetizar a anilina C6H5NH2, que é um composto amplamente usado para a preparação de pesticidas, gengivas, corantes, explosivos e medicamentos.
A obtenção de anilina ocorre reduzindo o nitrobenzeno em meio ácido na presença de ferro ou estanho, que é realizado de acordo com as seguintes etapas:
Nitrobenzeno → nitrosobenzeno → fenil -hidroxilamina → anilina
C6H5NÃO2 → c6H5Não → c6H5NHOH → c6H5NH2
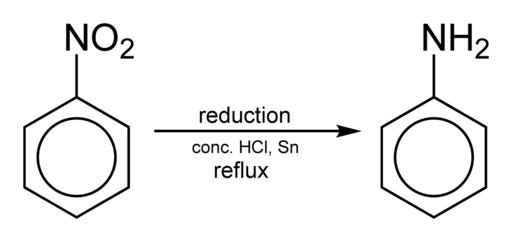 Redução de nitrobenceno para obter anilina. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Redução de nitrobenceno para obter anilina. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Dependendo das condições, o processo pode ser interrompido em uma das etapas intermediárias, por exemplo, em fenil -hidroxilamina. A partir de fenil-hidroxilamina em um ambiente fortemente ácido, o para-aminofenol pode ser preparado:
Fenilhdroxilamina → p-Aminofenol
C6H5NHOH → Hoc6H4NH2
Este último é tratado com anidrido acético para obter paracetamol (acetaminofeno) um analgésico antipirético e suave suave, ou seja, um medicamento para tratar febre e dor e dor.
 Às vezes é possível medicar com acetaminofeno para crianças com febre. Acetaminofeno é um derivado de nitrobenzeno. Autor: Augusto Ordonez. Fonte: Pixabay.
Às vezes é possível medicar com acetaminofeno para crianças com febre. Acetaminofeno é um derivado de nitrobenzeno. Autor: Augusto Ordonez. Fonte: Pixabay.  Pílulas de acetaminofeno, um derivado de nitrobenzeno. Paracetamol_acetaminophen_500_mg_pils.JPG: Tribo Michelle de Ottawa, Trabalho Canaderivativo: Anrie [CC por (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons.
Pílulas de acetaminofeno, um derivado de nitrobenzeno. Paracetamol_acetaminophen_500_mg_pils.JPG: Tribo Michelle de Ottawa, Trabalho Canaderivativo: Anrie [CC por (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons. Outra maneira de obter anilina é reduzir o nitrobenzeno com monóxido de carbono (CO) em meio aquoso na presença de partículas muito pequenas (nanopartículas) de paládio (PD) como catalisador.
C6H5-NÃO2 + 3 co + h2O → c6H5-NH2 + 3 co2
Ao obter outros compostos químicos
Nitobenzeno é o ponto de partida para obter uma grande variedade de compostos usados, como corantes, pesticidas, medicamentos e cosméticos.
 Alguns corantes são obtidos graças ao nitrobenzeno. Autor: Edith Lüthi. Fonte: Pixabay.
Alguns corantes são obtidos graças ao nitrobenzeno. Autor: Edith Lüthi. Fonte: Pixabay. Por exemplo, permite obter 1.3 dinitrobenceno que, por cloração (adição de cloro) e redução (eliminação de átomos de oxigênio), gera 3-cloroanilina. Isso é usado como intermediário para pesticidas, corantes e medicamentos.
Nitobenzeno foi usado para preparar a benchidina que é um corante. Além disso, o nitrobenzeno serve para preparar quinolina, azobenzeno, ácido metanil, dyitobenzeno, isocianato ou piroxilina entre muitos outros compostos.
Em várias aplicações
O nitobenzeno é usado ou usado como:
Pode atendê -lo: hidrocarbonetos insaturados- Solvente de extração para a purificação de óleos lubrificantes usados em máquinas
- Solvente para éteres de celulose
- Ingrediente da mistura para metais poloneses
- Em sabonetes
- Em misturas para sapatos poloneses
- Conservador de tinta spray
- Componente de mistura de polimento de piso
- Substituto de essência de amêndoa
- Na indústria de perfumes
- Na produção de borracha sintética
- Solvente em vários processos
 Nitobenzeno faz parte de algumas misturas para polir sapatos. D-Kuru [CC BY-SA 3.0 em (https: // CreativeCommons.Org/licenças/BY-SA/3.0/at/ação.em)]. Fonte: Wikimedia Commons.
Nitobenzeno faz parte de algumas misturas para polir sapatos. D-Kuru [CC BY-SA 3.0 em (https: // CreativeCommons.Org/licenças/BY-SA/3.0/at/ação.em)]. Fonte: Wikimedia Commons. Riscos
O nitobenzeno é tóxico por inalação, ingestão e absorção através da pele.
Irrita a pele, os olhos e o trato respiratório. Pode causar um tipo de anemia chamada metaglobinemia que consiste em reduzir a capacidade dos glóbulos vermelhos de liberar oxigênio nos tecidos e gera fadiga.
Além disso, o nitrobenceno causa dispnéia, tontura, visão perturbada, falta de respiração, colapso e morte. Também danifica o fígado, o baço, os rins e o sistema nervoso central.
Estima -se que possa ser um mutagênico e possivelmente causar câncer humano, como causou -o em animais.
Além disso, o nitrobenceno não deve ser descartado no ambiente. Sua toxicidade em relação aos animais, plantas e microorganismos torna muito prejudicial para os ecossistemas.
A toxicidade para os microorganismos diminui sua biodegradabilidade.
Tratamentos para a eliminação do meio ambiente
A poluição do meio ambiente com nitrobenceno pode ocorrer através do desperdício de várias indústrias que o usam, como a indústria para colorir ou a dos explosivos.
O nitobenzeno é altamente tóxico e difícil de quebrar em condições naturais, por esse motivo, pode causar contaminação potável grave e semear sistemas de irrigação.
Devido à sua alta estabilidade e toxicidade em relação aos microorganismos, é frequentemente selecionado como um modelo em estudos de tratamento de esgoto.
Várias maneiras estão sendo investigadas para eliminar o nitrobenzeno de água contaminado. Um deles é através da degradação fotocatalítica, ou seja, usando a luz solar como um acelerador da reação de degradação na presença de dióxido de titânio de titânio2.
 Com um reator de luz solar, é possível eliminar a poluição da água com o nitrobenceno. Mihai-Cosmin Pascariu [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Com um reator de luz solar, é possível eliminar a poluição da água com o nitrobenceno. Mihai-Cosmin Pascariu [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Os métodos de microeletrólise também foram testados com sucesso com um catalisador de ferro (fé) e cobre (Cu) em cerâmica. A microeletrólise permite que o nitrobenzeno se decomponha através de uma corrente elétrica.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Nitrobenzeno. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Morrison, r.T. e boyd, r.N. (2002). Química orgânica. 6ª edição. Prentice-Hall.
- Moldoveanu, s.C. (2019). Pirólise de outros compostos de nitrogênio. Em pirólise de moléculas orgânicas (segunda edição). Recuperado de cientedirect.com.
- Smith, p.C.G. et al. (1969). Compostos nitro-nitro aromáticos. Substituições eletrofílicas. Em química aromática. Recuperado de cientedirect.com.
- Windholz, m. et al. (Editores) (1983). O índice Merck. Uma eniclopédia de produtos químicos, medicamentos e biológicos. Décima edição. Merck & co., Inc.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Volume A22. Vch verlagsgellschaft mbh.
- Whang, t.-J. et al. (2012). Degradação fotocatalítica de nitrobenzeno por titânia de nitrobenzeno por titânia no tubo de quartzo. International Journal of Photoenergy, Volume 2012, Artigos ID 681941. Hyndowi se recuperou.com.
- Shikata, t. et al. (2014). Formação de dímero anti-paralelo nitrobenzeno em solventes não polares. AIP Advances 4, 067130 (2014). Recuperado de Doaj.org.
- Krogull-Obczak, a. et al. (2019). Redução de nitrobenzeno para anilina por co/h2Ou na testemunha de nanopartículas de paládio. Catalisadores 2019, 9, 404. MDPI se recuperou.com.
- Yang, b. et al. (2019). Produção em escala piloto, propriedades e aplicação de Fe/Cu Catalytic-Ceramic-Filler para compostos de nitrobenzeno Tratamento de águas residuais. Catalisadores 2019, 9, 11. MDPI se recuperou.com.
- « Fórmula de vantagem mecânica, equações, cálculo e exemplos
- 110 frases eternas de amor para namorados e maridos »

