Propriedades de nitritos, estrutura, nomenclatura, treinamento
- 5124
- 1569
- Dennis Heidenreich
O nitritos Eles são todos aqueles compostos que contêm ânion não2-, Se eles são inorgânicos, ou o grupo -Ono, se forem orgânicos. A grande maioria são nitritos de metal, que são sais inorgânicos onde não2- interagir eletroestaticamente com cesia Cn+; Por exemplo, o cátion de sódio, na+.
Assim, nitrito de sódio, nano2, É um exemplo de composto de sal ou nitrito. Esses sais são encontrados na natureza, em solos, mares, mamíferos e tecidos vegetais, pois fazem parte do ciclo biológico do nitrogênio. Portanto, não2- É uma substância presente em nossos organismos e está ligada a processos vasodilatadores.
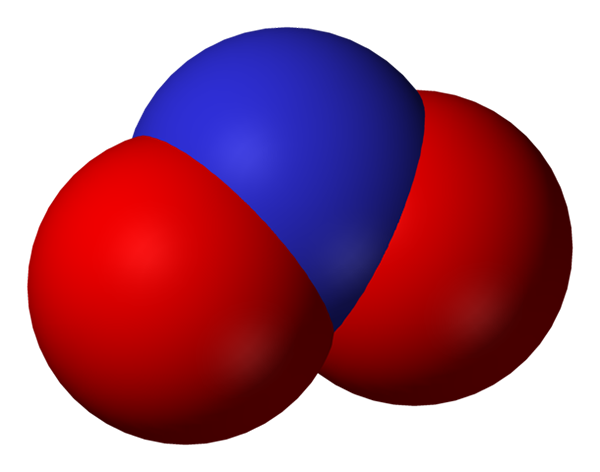
 Espaço cheio de ânion nitrito. Fonte: Benjah-BMM27.
Espaço cheio de ânion nitrito. Fonte: Benjah-BMM27. O nitrito se torna uma forma menor de nitrogênio, ou menos oxidada, que o nitrato, não3-. O óxido nítrico ocorre a partir dele, não nas regiões do organismo onde há deficiência de oxigênio. Ele não é uma molécula de sinalização que exerce um efeito vasodilatador relaxando os músculos e artérias.
Fora de bioquímica e medicina, os nitritos são usados como bactericidas, sendo sua agregação a carnes bastante comuns. Isso com o objetivo de curá -los e estender sua qualidade e frescura por mais tempo.
O nitrito tem duas faces: uma benéfica para a saúde e outra que o coloca em perigo. O rosto bom é precisamente devido às reações que o reduzem a não. Enquanto isso, o rosto ruim se deve à sua transformação em nitrosamina: uma família de compostos orgânicos que têm vários membros que foram reconhecidos como substâncias carcinogênicas.
[TOC]
Propriedades de nitritos
Basicidade
Nitritos são sais básicos, porque o ânion não2- É a base conjugada do ácido nitroso, hno2:
Hno2 + H2Ou ⇌ Não2- + H3QUALQUER+
Na água e em algumas quantidades, é hidrolisado para originar íons oh-:
NÃO2- + H2Ou ⇌ hno2 + Oh-
Essa basicidade é intrínseca para todos os sais de nitrito, pois depende de não2- e não dos cátions que o acompanham. No entanto, esses cátions e suas interações com o não2- Eles afetam as solubilidades dos sais de nitrito em água e outros solventes polares.
Reações
As reações de nitritos variam dependendo de quais cátions acompanham o não2-, ou se é um nitrito orgânico, Rono. Em termos gerais, os nitritos podem se decompor, oxidar ou reduzir para: óxidos metálicos, não3-, NÃO2, Não, e até gás nitrogênio, n2.
Pode atendê -lo: processos termodinâmicosPor exemplo, nitrito de amônio, NH4NÃO2 pode se decompor para n2 e h2QUALQUER.
Aparências físicas
Quase todos os nitritos são sólidos de aparência cristalina. Muitos são cores esbranquiçadas ou amareladas, embora sejam coloridas se eles contiverem metais de transição cátions.
Por outro lado, principalmente nitritos orgânicos são altamente instáveis e líquidos voláteis explosivos.
Estrutura
Ânion nitrito
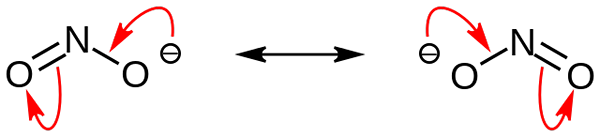 Estruturas de ressonância ânion nitrito. Fonte: Nohingserius / Pub Domain
Estruturas de ressonância ânion nitrito. Fonte: Nohingserius / Pub Domain Na primeira imagem, o ânion nitrito foi mostrado com um modelo de espaço completo. Este modelo tem a desvantagem exatamente a mesma que a de dióxido de nitrogênio, não2. Por outro lado, a imagem superior descreve melhor o ânion nitrito e como sua carga negativa se comporta.
Essa carga é realocada entre os dois átomos de oxigênio, então cada um tem metade da referida carga negativa (-1/2). E é esse ônus negativo responsável por atrair cátions vizinhos devido à simples atração eletrostática.
Sólidos
Nitritos inorgânicos são todos compostos sólidos cristalinos. Suas interações são puramente eletrostáticas, tendo uma atração entre o não2- e cátions mn+. Assim, por exemplo, o nano2 Possui uma estrutura cristalina ortorrômbica e é formada por íons Na+ e não2-.
O tipo de estrutura cristalina dependerá da identidade de M+n, Portanto, nem todos os nitritos compartilham uma estrutura ortorrômbica.
Nitritos orgânicos
Nitritos orgânicos, diferentemente dos inorgânicos, não são compostos iônicos, mas covalentes. Eles são, portanto, formados de moléculas, que são caracterizadas por ter um link R-AON, onde r pode ser um grupo alquil ou aromático.
Eles são considerados ésteres de ácido nitroso, pois seu hidrogênio, H-Don, é substituído por um grupo R:
 Fórmula geral para um nitrito orgânico. Fonte: PNGBOT via Wikipedia.
Fórmula geral para um nitrito orgânico. Fonte: PNGBOT via Wikipedia. De acordo com a imagem superior, este éster pode ser escrito como rum = O, muito semelhante à fórmula de ésteres de carbono, roc = O. Observe a grande semelhança que essa estrutura tem com a dos compostos nitro, RNO2, onde agora o link principal é R-No2 E não R-Dono. A única diferença está, portanto, no átomo com o qual se junta2 para o grupo r.
É por esse motivo que ésteres de nitrito e compostos nitro são considerados isômeros de ligação, pois têm os mesmos átomos, mas vinculados de maneira diferente.
Complexo
Os complexos de nitrito podem ter componentes inorgânicos e orgânicos. Eles formam um elo de coordenação entre um centro de metal e um dos não oxigênio2-. Isto é, não se fala de uma interação puramente eletrostática, Mn+NÃO2-, mas de coordenação mn+-OU NÃO-.
Pode atendê -lo: quais são as propriedades físicas da matéria?Nitritos orgânicos e seus complexos estabelecerão ou não estruturas cristalinas, dependendo de suas interações conseguirem definir suas partículas no espaço.
Nomenclatura
Nitritos inorgânicos e orgânicos compartilham uma nomenclatura consideravelmente simples. Para nomeá -los, as palavras 'nitrito de', seguidas pelo nome do metal e sua valência escritas entre parênteses são colocadas primeiro. Da mesma forma, os finais -co e -so no caso de haver mais de uma valência pode ser usada.
Por exemplo, o Cuno2 pode ser nomeado de duas maneiras: nitrito de cobre (i) ou nitrito cuprous.
Esta regra de nomenclatura também se aplica a nitritos orgânicos. Por exemplo, Cho3Ono é chamado de metilo nitrito, porque ch3 corresponde ao grupo R vinculado ao oxigênio no2.
A nomenclatura pode se tornar complicada se houver outros grupos de relevância química igual ou maior do que o não2, ou se eles são complexos metálicos.
Treinamento
Nitrificação
Muitos nitritos inorgânicos são formados na natureza em uma das etapas do ciclo de nitrogênio: nitrificação. Este processo consiste na oxidação da amônia realizada por microorganismos, especificamente, por bactérias nitrosomonas.
A nitrificação também abrange a oxidação subsequente de nitrato em nitrato; No entanto, a formação de nitrito é o passo lento dessas reações, pois requer maior energia e deve superar uma maior barreira cinética.
A equação a seguir exemplifica os recém -expostos:
2NH4+ + 3º2 → 2No2- + 4h+ + 2h2QUALQUER
Várias enzimas participam dessa reação e a hidroxilamina é produzida, NH2Oh, que é o produto do qual os ânions de nitrito finalmente se originarão.
É graças à nitrificação que as plantas contêm nitritos e, por sua vez, os animais que as consomem. Os nitritos não estão apenas presentes no solo, mas também nos mares, e quase toda a sua produção natural se deve à ação oxidativa e anaeróbica de vários microorganismos.
Óxidos de nitrogênio em meios básicos
Os nitritos dos metais alcalinos podem ser preparados industrialmente, borbulhando óxidos de nitrogênio em soluções básicas ou meios, seja de seus respectivos hidróxidos ou carbonatos. Por exemplo, o nitrito de sódio ocorre de acordo com a seguinte reação:
Não +não2 + NaOH → 2nano2 + H2QUALQUER
No caso de nitrito de amônio, o trióxido de dyitrogênio é borbulhado em amônia:
Pode atendê -lo: Rodio: História, Propriedades, Estrutura, Usos, Risco2NH3 + H2Ou +n2QUALQUER3 → 2NH4NÃO2
Reação com óxido nítrico
Alquilico Nitrite, Rono, pode ser sintetizado por reagir. A reação geral seria a seguinte:
R-OH → R-AON
Aplicação de nitritos
Cura de carne
 A cor avermelhada da carne é devido à sua cura com sais de nitrato e nitrato. Fonte: pxhere.
A cor avermelhada da carne é devido à sua cura com sais de nitrato e nitrato. Fonte: pxhere. Os nitritos têm efeitos antibacterianos, para que sejam adicionados em quantidades moderadas à carne para desacelerar sua podridão. Além de cumprir essa função, eles reagem com proteínas de carne para conceder -lhes uma coloração mais avermelhada e atraente.
O lado ruim dessa prática é que algumas carnes podem ter muitos sais de nitrito e, ao cozinhá -las a altas temperaturas, elas se transformam em nitrosoaminas. Portanto, existe o risco de aumentar as chances de contrair algum tipo de câncer se o consumo dessas carnes curadas for excessivo.
Corantes da haste
Os nitritos são usados na química orgânica para realizar a reação de diazotação, com a qual a coloração ou os corantes são sintetizados.
Pigmentos
Alguns complexos de nitrito, como o cobalto, podem ser usados como pigmentos para pinturas ou porcelana devido a suas cores impressionantes.
Vasodilatador
Os nitritos são responsáveis por gerar óxido nítrico no corpo em regiões deficientes de oxigênio. Ele não é uma molécula de sinalização, que responde aos vasos sanguíneos relaxando e expandindo. Essa expansão ou dilatação tem como conseqüência que a pressão arterial diminui.
Exemplos de nitritos
Finalmente, alguns exemplos de nitritos serão listados com suas respectivas fórmulas e nomes:
-Irmão mais velho2: nitrito de sódio
-Kno2: nitrito de potássio
-Mg (não2)2: Nitrito de magnésio
-Bico; esquichar2)2: nitrito de cálcio
-CH3CH2Ono: nitrito de etila
-NH4NÃO2: nitrito de amônio
-Zn (não2)2: nitrito de zinco
-PB (não2)2: Nitrito de chumbo (ii) ou nitrito de plumbose
-Fé (não2)3: Nitrito de ferro (iii) ou nitrito férrico
-(CH3)2Chch2CH2Ono: Isoamilo nitrito
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10ª edição.). Wiley Plus.
- Wikipedia. (2020). Nitrito. Recuperado de: em.Wikipedia.org
- Elsevier b.V. (2020). Nitrito. Cientedirect. Recuperado de: ScientEdirect.com
- Alfa Aesar. (2020). Sais de nitrito. Themo Fisher Scientific. Recuperado de: Alfa.com
- Os editores da Enyclopaedia Britannica. (23 de fevereiro de 2018). Nitritos. Encyclopædia britannica. Recuperado de: Britannica.com
- Anthony r. Butler e Martin Feelisch. (22 de abril de 2018). Usos terapêuticos de nitrito e nitrato inorgânicos. doi.org/10.1161/circulaçãohaha.107.753814
- Gunnars de Kris. (10 de fevereiro de 2020). São nitratos e nitritos em alimentos prejudiciais? Recuperado de: Healthline.com
- « Teoria do comportamento social, tipos, normas, exemplos
- Formação de compostos binários, tipos, exemplos, nomenclatura »

