Formação de compostos binários, tipos, exemplos, nomenclatura
- 1525
- 268
- Ralph Kohler
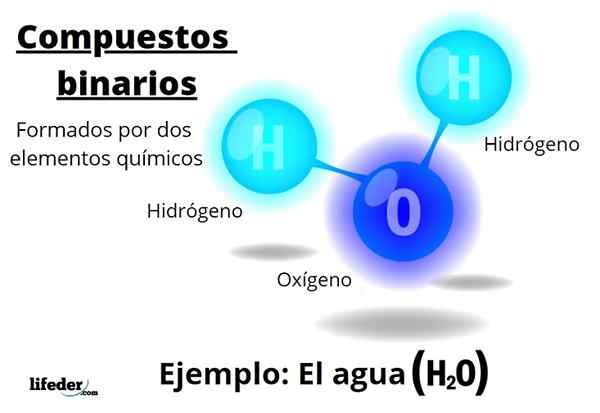
O compostos binários Todos são formados por dois elementos químicos, independentemente do número de seus átomos ou de suas interações. A fórmula geral para esses compostos énBm, onde A e B são dois elementos diferentes da tabela periódica e n e m seus respectivos coeficientes estequiométricos.
Por exemplo, água, h2Ou, é um composto binário, sendo talvez o mais representativo deles. A água consiste em hidrogênio, h e oxigênio, ou, assim, adicionando dois elementos químicos. Observe que seus coeficientes estequiométricos indicam que existem dois átomos de hidrogênio e um oxigênio, mas ainda é um composto binário.

Compostos binários podem consistir em íons, moléculas, redes tridimensionais ou até átomos de metal neutros. O importante é que qualquer que seja a natureza de sua ligação química ou de sua composição sempre formada por dois elementos químicos diferentes. Por exemplo, gás hidrogênio, h2, não conta como composto binário.
Compostos binários podem não parecer, inicialmente, tão abundantes e complexos em comparação com compostos ternários ou quaternários. No entanto, entre eles estão muitas substâncias essenciais para os ecossistemas terrestres, como sais, óxidos, sulfetos e alguns gases de imenso valor biológico e industrial.
[TOC]
Como são os compostos binários?
Métodos de preparação ou rotas sintéticas para formar compostos binários dependerão das identidades dos dois elementos químicos A e B. No entanto, em princípio e em geral, ambos os elementos devem ser combinados em um reator para que possam interagir entre si. Assim, se as condições forem favoráveis, uma reação química ocorrerá.
Tendo uma reação química, os elementos A e B se juntarão ou vincularão (iônico ou covalentemente) para formar o composto paranBm. Muitos compostos binários podem ser formados pela combinação direta de seus dois elementos puros ou seguindo outros métodos alternativos mais economicamente viáveis.
Pode atendê -lo: óxido de zinco (ZnO): estrutura, propriedades, usos, riscosRetornando ao exemplo de água, hidrogênio, h2, e oxigênio, ou2, Eles se combinam em altas temperaturas para que haja uma reação de combustão entre eles:
2h2(g) + ou2(g) → 2h2O (G)
A água, por outro lado, pode ser obtida através de reações de desidratação de compostos como álcoois e açúcares.
Outro exemplo de formação de um composto binário corresponde ao sulfeto ferroso, FES:
Fé (s) + s (s) → fes (s) (s) (s)
Onde desta vez, ferro e enxofre são sólidos e não substâncias de refrigerante. E isso é o mesmo com vários sais binários, por exemplo, cloreto de sódio, NaCl, combinando sódio metálico com gases de cloro:
2NA (S) + CL2(g) → 2NAcl (s)
Nomenclatura
Os nomes de todos os compostos binários são governados principalmente pelas mesmas regras.
Para o complexo paranBm, O nome B é mencionado primeiro em sua forma aniônica; isto é, com o fim -uro. No entanto, no caso de B consiste em oxigênio, é nomeado como um óxido, peróxido ou superóxido como aplicado.
O nome de B é precedido por prefixos de números gregos (mono, di, tri, tetra, etc.) de acordo com o valor de m.
Finalmente, o nome do elemento A é mencionado. No caso de ter mais de uma valência, é indicado com números romanos e entre parênteses. Ou, se preferir, você pode escolher a nomenclatura tradicional e usar os sufixos -ooso e -ico. O elemento A às vezes também é precedido por prefixos de números gregos de acordo com o valor de n.
Considere os seguintes compostos binários, juntamente com seus respectivos nomes:
-H2O: óxido de hidrogênio ou monóxido de di -hidrogênio (este sobrenome é uma causa de provocação)
-FES: sulfeto de ferro (II) ou sulfeto ferroso
-NaCl: cloreto de sódio ou cloreto de sódio
Pode atendê -lo: petróleo ou éter benzina: fórmula, estrutura, usa-Mgcl2: cloreto de magnésio, cloreto magnético ou dicloreto de magnésio
Observe que não é dito 'cloreto de monossódio' ou 'monohierro sulfeto'.
Tipos: Classificação de compostos binários
Os compostos binários são classificados de acordo com o que são formados ou fatos: íons, moléculas, átomos de metal ou redes. Mesmo assim, essa classificação não é totalmente conclusiva ou definitiva, sendo capaz de variar dependendo da abordagem considerada.
Iônico
Em compostos binários iônicos, A e B consistem em íons. Assim, para o composto paranBm, B geralmente é um ânion, B-, Enquanto um cátion, para+. Por exemplo, o NACL pertence a essa classificação, bem como a todos os sais binários, cujas fórmulas gerais são melhor representadas como mx, onde x é um ânion, e M um cátion metálico.
Assim, fluoretos, cloretos, bromuros, iodeto., Eles também pertencem a esta classificação. No entanto, deve -se notar que alguns deles são covalentes, portanto, pertencentes à seguinte classificação.
Covalente
Os compostos binários covalentes são formados por moléculas. A água pertence a essa classificação, pois consiste em moléculas H-O-H. O cloreto de hidrogênio, HCL, também é considerado um composto binário covalente, pois consiste em moléculas H-Cl H-Cl. Observe que o NaCl é iônico, enquanto o HCl é covalente, ambos os cloretos sendo.
Metálico ou redes
Compostos binários também cobrem as ligas e sólidos de redes tridimensionais. No entanto, para eles, a denominação de materiais binários é geralmente usada melhor.
Por exemplo, bronze, mais que um composto, é considerado um material binário ou liga, pois é formado por cobre e zinco, cu-zn. Observe que não está escrito por não ter coeficientes estequiométricos definidos.
Da mesma forma, há dióxido de silício, Sio2, formado por silício e oxigênio. Seus átomos estão ligados definindo uma rede tridimensional, onde você não pode falar sobre moléculas ou íons. Muitos nitretos, fosfon e carbonetos, quando não são iônicos, também são sobre esse tipo de redes.
Pode atendê -lo: ácido fenoxiacético: síntese, procedimento, usos, riscosExemplos de compostos binários
 A água é um exemplo de composto binário
A água é um exemplo de composto binário Ele será listado para terminar vários compostos binários acompanhados por seus respectivos nomes:
-Libr: brometo de lítio
-CACL2: cloreto de cálcio
-FECL3: cloreto de ferro (iii) ou cloreto férrico
-Nao: óxido de sódio
-Beh2: hidreto de berílio
-Co2: dióxido de carbono
-NH3: Nitrogênio ou tri -hidreto
-PIB2: Iodeto de chumbo (ii) ou chumbo diyoduro
-Mg3N2: Magnésio nituro
-Para o2QUALQUER3: Óxido de alumínio ou trióxido de diumumum
-N / D3Q: fosfuro de sódio
-Alf3: Fluoreto de alumínio
-Racl2: cloreto de rádio ou dicloreto de rádio
-BF3: Boro Trifluoruro
-RBI: Rubidio Yoduro
-WC: Carboneto de tungstênio ou Wolframium
Cada um desses exemplos pode ter mais de um nome de cada vez. Destes, o CO2 Tem um grande impacto na natureza, como é usado pelas plantas no processo de fotossíntese.
Por outro lado, o NH3 É uma das substâncias com mais valor industrial, necessário para a síntese de síntese polimérica e orgânica. E, finalmente, o WC é um dos materiais mais difíceis já criados.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Artem Cheprasov. (2020). O que é um composto binário? - Definição e exemplo. Estudar. Recuperado de: estudo.com
- Helmestine, Anne Marie, Ph.D. (11 de fevereiro de 2020). Definição de composto binário. Recuperado de: pensamento.com
- Byju's. (2020). O que são compostos binários? Recuperado de: byjus.com
- ChemTeam. (s.F.). Compostos binários de metais com cargas fixas. Recuperado de: chemteam.Informações
- Wikipedia. (2020). Fase binária. Recuperado de: em.Wikipedia.org
- « Propriedades de nitritos, estrutura, nomenclatura, treinamento
- Floculação de reação, tipos, aplicações, exemplos »

