Propriedades de nitrila, nomenclatura, usos, exemplos

- 3417
- 328
- Mr. Reginald Lindgren
O Nitrilos São todos os compostos orgânicos que possuem o grupo funcional da CN, que também é chamado de ciano, ou cianeto em termos de química inorgânica. Nitrilas alifáticas são representadas com a fórmula geral da RCN, enquanto nitriles aromáticos com a fórmula Arcn.
Embora o cianeto de hidrogênio, o HCN, e os sais de metal de cianeto sejam compostos altamente tóxicos, exatamente o mesmo não acontece com nitriles. O grupo CN em um esqueleto de carbono de qualquer tipo (ramificado, linear, aromático, etc.), ele se comporta diagonalmente diferente de um ânion de cianeto, CN-.
 Fórmula geral para um nitrilo alifático. Fonte: Benjah-BMM27 via Wikipedia.
Fórmula geral para um nitrilo alifático. Fonte: Benjah-BMM27 via Wikipedia. Os nitriles são muito divulgados no mundo dos plásticos, pois vários deles derivam de acrilonitrila, CH2CHCN, um nitrilo com o qual os polímeros são sintetizados, como borrachas de nitrila, usadas para fazer cirurgia ou luvas de laboratório. Os nitriles também estão presentes em muitos produtos naturais e farmacêuticos.
Por outro lado, os nitriles são precursores de ácidos carboxílicos, uma vez que sua hidrólise representa um método alternativo de síntese para obter o último.
[TOC]
Características e propriedades
Estrutura
As estruturas moleculares dos nitriles variam dependendo da identidade de R ou AR nos compostos RCN ou ARCN, respectivamente.
No entanto, a geometria do grupo CN é linear devido ao seu link triplo, C≡N, que é o produto da hibridação SP. Assim, os átomos de C-C bl estão localizados na mesma linha. Além desses átomos, pode haver qualquer estrutura.
Polaridade
Os nitriles são compostos polares, uma vez que o nitrogênio do grupo CN é muito eletronegativo e atrai elétrons para si mesmo. Portanto, eles têm pontos de fusão ou de ebulição mais altos do que seus homólogos para.
Pode servir a você: Scandio: História, Propriedades, Reações, Riscos e UsosPor exemplo, acetonitrila, CHO3CN, é um líquido que ferve a 82 ºC; Enquanto Etano, CH3CH3, É um gás que ferve a -89 ºC. Observe o grande efeito que o grupo CN tem nas interações intermoleculares.
O mesmo raciocínio se aplica a maiores compostos: se eles tiverem um ou mais grupos de CN em sua estrutura, é bem provável que sua polaridade aumente e esteja mais relacionada a superfícies ou líquidos polares.
Basicidade
Pode -se pensar que, devido à alta polaridade dos nitriles, essas são bases relativamente fortes na frente das aminas. No entanto, devemos considerar as ligações covalentes Ceg e o fato de que tanto o carbono quanto o hidrogênio têm hibridação de SP.
A basicidade do RCN: é representada ao aceitar um próton da água: água:
Rcn: + h2Ou ⇌ rcnh+ + Oh-
Protone o RCN: o torque livre de elétrons no nitrogênio deve formar um link com o íon h+. Mas há um inconveniente: a hibridação de nitrogênio o torna muito eletronegativo, tanto que esse par de elétrons é fortemente atraído e nem permite que um vínculo se forme.
Portanto, diz -se que o par de nitrogênio nitrogênio não está disponível e que a basicidade de nitrilos é muito baixa. De fato, os nitriles são milhões de vezes menos básico que as aminas.
Reatividade
Entre as reações mais representativas dos nitrilos, temos sua hidrólise e redução. Essas hidrólise são mediadas pela acidez ou basicidade do ambiente aquoso, causando um ácido carboxílico ou um sal de carboxilato, respectivamente:
Pode atendê-lo: equilíbrio de vapor líquidoRcn + 2h2O + HCl → Rcooh + NH4Cl
RCN + H2O + Naoh → Rcona + NH3
No processo, um amida também é formado.
Os nitriles são reduzidos a aminas usando catalisadores de hidrogênio e metal:
RCN → RCH2NH2
Nomenclatura
De acordo com a nomenclatura da IUPAC, as nitrilas são nomeadas adicionando o sufixo -nitrila ao nome da cadeia alcana da qual deriva, incluindo também o carbono do ciano. Assim, Cho3CN é chamado Ethanonitrilo, e Cho3CH2CH2CN, butanonitrila.
Eles também podem ser nomeados com o nome de ácido carboxílico, que é eliminado pela palavra 'ácido', e os sufixos são substituídos -óicos ou -Oico pelo sufixo -onitrila. Por exemplo, para CH3A CN seria acetonitrila (ácido acético); Para c6H5CN, seria benzonitrila (de ácido benzóico); E para ele (Cho3)2CHCN, 2-metilpropanitrila.
Como alternativa, se os nomes dos substituintes alquilicâssicos forem considerados, os nitriles podem ser mencionados usando a palavra 'cianeto'. Por exemplo, Cho3CN seria então chamado de cianeto de metila e (Cho3)2CHCN, cianeto de isopropil.
Formulários
Os nitriles fazem parte de produtos naturais, estando em amêndoas amargas, nos ossos de várias frutas, em animais marinhos, plantas e bactérias.
Seus grupos CN compõem as estruturas de lipídios e glicosídeos cianogênicos, biomoléculas que, quando degradadas, liberam cianeto de hidrogênio, HCN, um gás altamente venenoso. Portanto, eles têm um uso biológico iminente para certas criaturas.
Dizia -se anteriormente que os grupos de CN dão muita polaridade às moléculas e, de fato, eles não passam despercebidos quando estão presentes em compostos com atividade farmacológica. Tais medicamentos para nitrila têm sido usados para combater a hiperglicemia, câncer de mama, diabetes, psicose, depressão e outros distúrbios.
Pode atendê -lo: reação irreversível: características e exemplosAlém de ter um papel na biologia e na medicina, eles compõem industrialmente um punhado de plásticos nitrônicos, com os quais são feitas luvas cirúrgicas e laboratoriais, selos de peças automotivas, mangueiras e articulações devido à sua resistência contra corrosão e gorduras, materiais como Tupperware, instrumentos musicais ou blocos de Legos.
Exemplos de nitrila
Em seguida e finalmente alguns exemplos de nitrilos serão listados.
Borrachas de nitrila
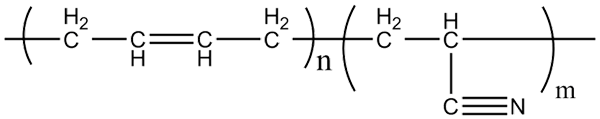 Estrutura molecular de copolímeros de acrilonitrila-butadieno. Fonte: Klever via Wikipedia.
Estrutura molecular de copolímeros de acrilonitrila-butadieno. Fonte: Klever via Wikipedia. Borracha de nitrila, com a qual as luvas e materiais resistentes a gordura são fabricados, é um copolímero formado por acrilonitrila e butadieno (acima). Observe como o grupo CN parece linear.
Ciamemazine
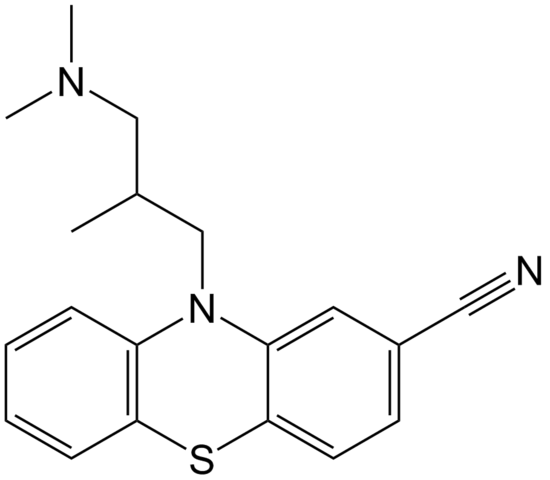 Estrutura molecular da cipemazina. Fonte: domínio EPOP / pub
Estrutura molecular da cipemazina. Fonte: domínio EPOP / pub A cyammazina é um exemplo de nitrila na área de farmácia que é usada como antipsicótica, especificamente para tratar distúrbios de ansiedade e esquizofrenia. Novamente, observe a linearidade do grupo CN.
Citalopram
 Outro medicamento de nitrila é o citalopram, usado como antidepressivo
Outro medicamento de nitrila é o citalopram, usado como antidepressivo Amygdalin
 Estrutura molecular da amigdalia. Fonte: Wesalius / Domínio Público
Estrutura molecular da amigdalia. Fonte: Wesalius / Domínio Público A amígdala é um exemplo de um glucóside cianogênico. É encontrado em amêndoas, ameixas, damascos e pêssegos amargos. Observe a aparência do grupo CN em relação ao restante da estrutura; Mesmo assim, sua presença única é suficiente para fornecer uma identidade química única a este carboidrato.
Referências
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10º Edição.). Wiley Plus.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison e Boyd. (1987). Quimica Organica. (Quinta edição). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Nitrila. Recuperado de: em.Wikipedia.org
- Química Librettexts. (5 de junho de 2019). Química de nitrilos. Recuperado de: química.Librettexts.org
- Jim Clark. (2016). Nitriles hidrolisando. Recuperado de: Chemguide.co.Reino Unido
- Ivy Rose Holística. (2020). Nitrila Nomeação. Recuperado de: ivirose.com
- Germán Fernández. (s.F.). Nitrila Nomenclatura: Regras da IUPAC. Recuperado de: Chemicicaorganica.org
- « As 8 principais correntes psicológicas e seus autores
- Estrutura de metilamina, propriedades, produção, usos »

