Estrutura de metilamina, propriedades, produção, usos
- 5067
- 125
- Melvin Mueller
O Metilamina É um composto orgânico cuja fórmula condensada é Cho3NH2. Especificamente, é a altáfina primária mais simples de todos, pois contém apenas um substituinte alquilico, o mesmo que dizer que existe apenas um link covalente C-N.
Em condições normais, é um gás de amônia que cheira a peixe, mas é relativamente fácil de condensar e transportar em tanques herméticos. Da mesma forma, pode ser dissolvido consideravelmente na água, causando soluções amareladas. Por outro lado, também pode ser transportado como sólido na forma de seu sal de cloridrato, CH3NH2· Hcl.
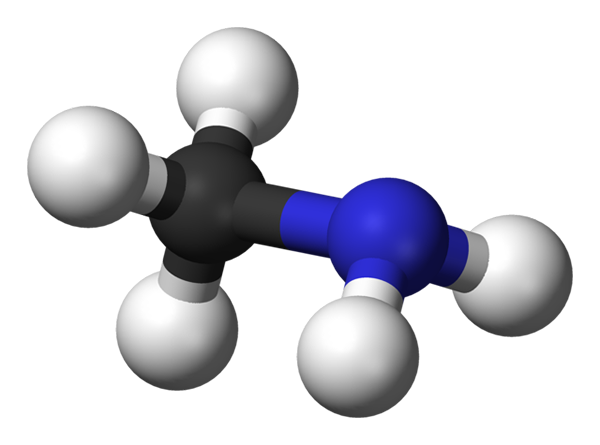
 Molécula de metilamina. Fonte: Benjah-BMM27 via Wikipedia.
Molécula de metilamina. Fonte: Benjah-BMM27 via Wikipedia. A metilamina ocorre industrialmente de amônia e metanol, embora existam muitos outros métodos de produção em escalas de laboratório. Seu gás é altamente explosivo; portanto, qualquer fonte de calor próxima a ele tem o potencial de causar um grande incêndio.
É um composto com alta demanda comercial, mas ao mesmo tempo apresenta fortes restrições legais porque serve como matéria -prima para medicamentos e substâncias psicotrópicas.
[TOC]
Estrutura
A imagem acima mostra a estrutura molecular da metilamina representada por um modelo de esferas e barras. A esfera preta corresponde ao átomo de carbono, o azul ao átomo de nitrogênio e o branco para os átomos de hidrogênio. É, portanto, uma molécula pequena, onde metano, CHO4, Perder um h para um grupo NH2, dando cap3NH2.
A metilamina é uma molécula altamente polar, porque o átomo de nitrogênio atrai densidade eletrônica de carbono e átomos de hidrogênio. Ele também tem a capacidade de formar pontes de hidrogênio entre o compêndio de suas forças intermoleculares. Cada molécula de CH3NH2 Você pode doar ou aceitar uma ponte de hidrogênio consecutiva (CH3HNH-NH2CH3).
Pode servir você: o que é teoria da banda?No entanto, sua massa molecular é consideravelmente baixa, além das portas CH3 Eles impedem essas pontes de hidrogênio. O resultado é que a metilamina é um gás em condições normais, mas isso pode ser condensado a uma temperatura de -6 ºC. Quando se cristalizando, faz isso após uma estrutura ortorrômbica.
Propriedades
Aparência física
Gas ou líquido colorido, mas cujas soluções aquosas podem apresentar tons amarelados.
Cheiro
Desagradável, semelhante ao de uma mistura de peixe e amônia.
Massa molar
31.058 g/mol
Ponto de fusão
-93.10 ºC
Ponto de ebulição
Em torno do -6 ºC. Portanto, é um gás que pode se condensar em temperaturas não muito frias.
Densidade
656,2 kg/m3 a 25 ºC. Seus vapores são 1,1 vezes denso que o ar, enquanto seu líquido ou condensado é cerca de 0,89 vezes menos denso que a água.
Pressão de vapor
À temperatura ambiente, sua pressão de vapor varia de 3,5 atm.
Momento dipolar
1.31 d
Solubilidade em água
1.080 g/L a 20 ºC. É um gás que se dissolve muito bem na água, porque ambas as moléculas são polares e relacionadas entre si ao estabelecer pontes de hidrogênio (CH3Hnh-oh2).
Basicidade
A metilamina tem uma constante de basicidade (PKb) de 3,36. Este valor indica que é uma substância consideravelmente básica, ainda mais do que a mesma amônia, por isso se dissolveu em água libera uma certa quantidade de íons OH- Quando hidrolisado:
CH3NH2 + H2Ou ⇌ Ch3NH3+ + Oh-
A metilamina é mais básica que a amônia porque seu átomo de nitrogênio tem maior densidade eletrônica. Isso é porque CHO3 Feito mais elétrons de nitrogênio do que os três átomos de hidrogênio na molécula NH3. Mesmo assim, a metyilamina é considerada uma base fraca na frente de outras altáfinas ou aminas.
Pode atendê -lo: tipo de link de CO2ponto de inflamação
-10 ºC a um copo fechado, o que significa que é um gás altamente inflamável e perigoso.
Temperatura de auto -dirigir
430 ºC
Tensão superficial
19,15 mn/m a 25 ºC
Decomposição
Quando queimaduras é decomposto termicamente em óxidos de carbono e nitrogênio, que formam uma fumaça tóxica.
Produção
A metilamina pode ser produzida ou sintetizada pelo método comercial ou industrial ou por métodos de laboratório em escalas inferiores.
Industrial
A metilamina ocorre industrialmente através da reação que ocorre entre amônia e metanol em um suporte de gel simpático catalítico. A equação química para esta reação é a seguinte:
CH3Oh + NH3 → cap3NH2 + H2QUALQUER
No processo, outras alquaminas podem ser geradas; No entanto, a metyilamina é o produto que cineneticamente parece mais favorecido.
Laboratório
No nível de laboratório, existem vários métodos que permitem a sintetização de metilamina de pequena escala. Um deles é a reação em um meio básico forte, de Koh, entre acetamida e bromo, durante o qual o metil isocianato é gerado, CH3NCO, que por sua vez é hidrolisado para se tornar a metilação.
A metilamina pode ser armazenada como sólida se neutralizada com ácido clorídrico, de modo que uma forma de sal de cloridrato seja formada:
CH3NH2 + Hcl → cap3NH2· Hcl
Então, o cloridrato de metilamina, também representado como [CH3NH3] CL, pode ser baseado em um local seguro para obter a solução aquosa com gás dissolvido:
[CH3NH3] Cl + Naoh → CH3NH2 + NaCl + H2QUALQUER
Por outro lado, a metilamina também pode ser sintetizada a partir da hexamina (CH2)6N4, que é diretamente hidrolisado com ácido clorídrico:
Pode atendê -lo: cristalização(CH2)6N4 + Hcl + 6 h2O → 4 NH4CL + 6 CH2QUALQUER
Consecutivamente, o cloreto de amônio reage com formaldeído quente para causar metilamina e vapores de ácido fórmico, hcooh.
Além disso, a metilamina pode ser obtida reduzindo o nitrometano, CH3NÃO2 com zinco metálico e ácido clorídrico.
Formulários
 A efedrina é um medicamento que precisa de metyilamina para produção comercial. Fonte: Turquia -formal.
A efedrina é um medicamento que precisa de metyilamina para produção comercial. Fonte: Turquia -formal. A metilamina é um composto cujos usos geralmente geram controvérsia, pois é uma substância usada na síntese de narcóticos, como a metanfetamina. De fato, sua popularidade se deve ao desejo de que os protagonistas da série Breaking Bad Television tivessem que obtê -lo a qualquer custo.
Este composto também é usado como matéria -prima para a produção de inseticidas, medicamentos, surfactantes, explosivos, corantes, fungicidas, aditivos, etc., Portanto, tem uma forte demanda mundial, além de múltiplas restrições legais para sua aquisição.
Sua imensa versatilidade química é devido à sua molécula CHO3NH2 É um bom agente nucleofílico, ligado ou coordenado a substratos de maior massa molecular em várias reações orgânicas. Por exemplo, isso é baseado na síntese da efedrina, onde Cho3NH2 Ele se junta a uma molécula com a conseqüente perda de um h.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10ª edição.). Wiley Plus.
- Wikipedia. (2020). Metilamina. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2020). Metilamina. Banco de dados PubChem., CID = 6329. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Dylan Matthews. (15 de agosto de 2013). Aqui está o que 'Breaking Bad' acerta e errado sobre o negócio de metanfetamina. Recuperado de: washingtonpost.com
- Prepchem. (2020). Preparação de cloridrato de metilamina. Recuperado de: Prepchem.com

