Propriedades de nitratos, estrutura, nomenclatura, treinamento
- 2830
- 553
- Terrell Stokes
O Nitratos Eles são todos aqueles compostos que contêm ânion não3-, Quando se trata de sais inorgânicos, ou do grupo Nitro, -OnO2, No caso de derivados orgânicos. Em inorgânico, todos os nitratos são sais de metal ou íons de amônio, em que as interações eletrostáticas M predominamn+NÃO3-.
Por exemplo, nitrato de sódio3, É formado por íons Na+ e não3-. Este sal, juntamente com nitrato de potássio, KNO3, são os espécimes de nitratos mais abundantes na natureza. Os nitratos encontrados nos solos, nos tecidos vegetais e acima de tudo, em mares e depósitos salinos, como salitre, localizados no Chile.
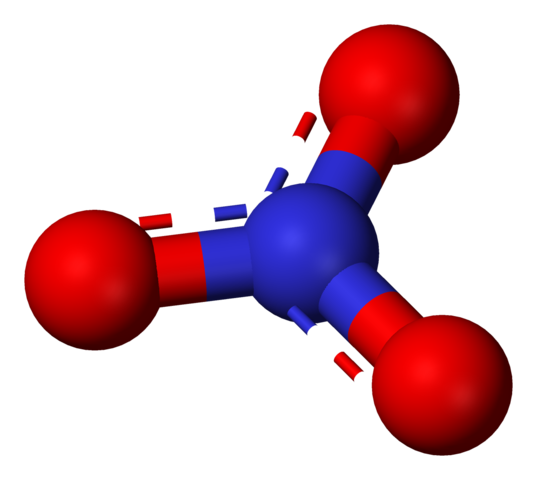
 Ânion nitrato representado por um modelo de esferas e barras. Fonte: Benjah-BMM27 / Domínio Público.
Ânion nitrato representado por um modelo de esferas e barras. Fonte: Benjah-BMM27 / Domínio Público. O termo 'nitratos' alude imediatamente a sais, fertilizantes e explosivos. Eles também estão relacionados a carnes e seus processos de cura para inibir o crescimento de bactérias e, assim, atrasar sua deterioração. Os nitratos também são sinônimos de vegetais, porque contêm grandes quantidades desses sais.
Ele nao3- (Imagem superior) é a forma mais oxidada de nitrogênio, sendo o produto final e assimilável de seu ciclo biológico. O nitrogênio da atmosfera sofre várias transformações, seja pelo trabalho dos raios elétricos ou por meio de ações microbianas, para se tornar NH4+ e não3-, ambos solúveis em água e absorvíveis pelas plantas.
Os nitratos são usados como agentes oxidantes, fertilizantes, explosivos e medicamentos cardiológicos. Esse último uso contrasta muito com os outros, pois eles metabolizam ou interagem com o corpo de tal maneira que dilatam veias e artérias; E, portanto, há um aumento e melhoria do fluxo sanguíneo, aliviando dores no coração.
[TOC]
Propriedades de nitratos
Neutralidade
Os nitratos são em princípio substâncias neutras, como não3- É a base conjugada de ácido nítrico, hno3, Um ácido forte. Na água, não é apreciável:
NÃO3- + H2Ou ⇌ hno3 + Oh-
De fato, pode -se dizer que essa hidrólise não ocorre, as quantidades de OH sendo desprezíveis-. Portanto, as soluções aquosas de nitrato são neutras, a menos que haja outras substâncias dissolvidas.
Aparências físicas
Nitratos inorgânicos consistem em sais cujas fórmulas gerais são M (não3)n, ser n É a Valência ou carga positiva do cátion metálico. Todos esses nitratos têm brilho cristalino e cores esbranquiçadas. No entanto, os metais de transição nitratos podem ser coloridos.
Por exemplo, nitrato de cobre (ii) ou nitrato cúprico, Cu (não3)2, É um sólido cristalino azulado. Enquanto isso, nitrato de níquel (ii), nem (não3)2, É uma cor de esmeralda sólida. Alguns outros nitratos, como ferro, apresentam cores fracas.
Por outro lado, os nitratos orgânicos geralmente são sólidos ou sólidos explosivos e explosivos.
Pode servir a você: Matéria Viva: Conceito, Características e ExemplosDecomposição termal
Os nitratos de metal são sensíveis a altas temperaturas, pois começam a quebrar de acordo com a seguinte equação química:
2M (não3)2(s) → 2mo (s)+4no2(g)+ou2(g)
Como observado, o nitrato de metal se decompõe em um óxido, MO e nitrogênio e dióxido de oxigênio. Essa decomposição térmica não ocorre na mesma temperatura para todos os nitratos; Alguns resistem mais do que outros.
Como regra geral, quanto maior e menor a carga de cátion m é+, maior será a temperatura na qual o nitrato deve ser aquecido para quebrar. Em vez disso, quando M+ É pequeno ou tem uma carga positiva grande, o nitrato se decompõe a temperaturas mais baixas, portanto mais instável.
Por exemplo, nitrato de sódio3, Se decompõe a uma temperatura inferior à do nitrato de bário, BA (não3)2, Bem, embora o ba2+ tem maior carga do que na+, Seu tamanho é muito maior.
Agente oxidante
Ele nao3- É um ânion relativamente estável. No entanto, seu átomo de nitrogênio é fortemente oxidado, com um estado de oxidação de +5 (n5+QUALQUER32-), Por isso está "sedento" de elétrons. Por esse motivo, o nitrato é um agente oxidante, que procurará arrebatar os elétrons de substâncias ao seu redor.
É essa falta de elétrons no átomo de nitrogênio de não3- O que o Nano faz3 E kno3 Agentes oxidantes fortes, usados como componentes da pólvora. Adicionando a essa característica o fato de que os gases são liberados2 EU2 Ao se decompor, entende -se por que faz parte de muitos explosivos.
Quando o nitrato ganha elétrons ou reduz, ele pode ser transformado em amônia, NH3, ou em óxido nítrico, não, dependendo de reagentes e condições.
Solubilidade
Todos os nitratos inorgânicos, ou o que é o mesmo, nitratos de metal e amônio, NH4NÃO3, São compostos solúveis em água. Isso ocorre porque as moléculas de água têm uma forte afinidade por não3-, E que as redes cristalinas desses nitratos não são muito estáveis.
Estrutura
Ânion nitrato
 Estruturas de ressonância de nitrato. Fonte: Benjah-BMM27 / Domínio Público.
Estruturas de ressonância de nitrato. Fonte: Benjah-BMM27 / Domínio Público. A imagem superior mostra as estruturas de ressonância do ânion nitrato. Como pode ser visto, duas cargas negativas estão localizadas em dois átomos de oxigênio, que são democalizados entre os três átomos de oxigênio. Portanto, cada um ou tem uma carga de -2/3, enquanto o nitrogênio tem uma carga de +1.
Então, o não3- Interação eletroestaticamente, ou links de coordenação, através de qualquer um de seus três átomos de oxigênio.
Sólidos
Todos os nitratos inorgânicos são salinos e iônicos. Portanto, suas estruturas são cristalinas, o que significa que seus íons, M+ e não3-, Eles estão organizados no espaço graças às suas interações eletrostáticas. Dependendo dessas interações, seus cristais apresentarão diferentes estruturas.
Pode atendê -lo: qual é o rombus de segurança e para que é?Por exemplo, a estrutura cristalina de Nano3 É trigonal ou rhomboédica, enquanto o do knO3 É ortorrômbico.
Nitratos orgânicos
Nitratos orgânicos são representados com a fórmula geral Rono2, onde r é um grupo alquil ou aromático. Esses compostos são caracterizados por seu link R-Aon2, e geralmente consistem em derivados nítricos de polímeros e outras substâncias orgânicas.
Complexo
Ele nao3- Coordena com os centros de metal para formar um link m+-OU NÃO2-, sendo uma interação diferente para Ionic. Esses complexos são essencialmente natureza inorgânica. O nitrato pode até ser coordenado usando dois de seus átomos de oxigênio ao mesmo tempo, M+-QUALQUER2NÃO.
Nomenclatura
Para nomear um nitrato, as palavras 'nitrato de' seguidas pelo nome do cátion ou do grupo que o acompanha em sua respectiva fórmula química devem ser escritas primeiro. A valência do cátion é especificada entre parênteses quando possui mais de um. Da mesma forma, os sufixos podem ser usados -co e -oy se preferir, seguindo a nomenclatura tradicional.
Por exemplo, considere a fé (não3)3. Seu nome é nitrato de ferro (iii), porque sua valência é +3 ou também pode ser chamada de nitrato férrico.
Essas regras também se aplicam a nitratos orgânicos, desde que suas estruturas sejam simples. Por exemplo, Cho3OU NÃO2 É chamado de nitrato de metila, porque o grupo -ch3 Torna -se o grupo R que acompanha -Ono2.
Treinamento
Natural
Os nitratos são formados na natureza como parte do ciclo biológico de nitrogênio. Por causa disso, os solos, os mares e algumas correntes de água têm quantidades significativas de nitratos. Dependendo dos íons circundantes, diferentes sais de nitratos serão formados, sendo nano3 E kno3 O mais comum e abundante.
Industrial
Os nitratos são formados em escalas industriais por neutralização do ácido nítrico, com hidróxidos de metal, álcoois, polímeros, etc. Por exemplo, nitrato de cálcio, CA (não3)2, Pode ser preparado de acordo com a seguinte equação química:
CA (OH)2 + 2hno3 → Ca (não3)2 + 2h2QUALQUER
Da mesma forma, várias substâncias orgânicas são atacadas por HNO3 sob certas condições para promover a substituição de alguns de seus grupos por -Ono2. É o que acontece com a reação da celulose para se transformar em nitrocelulose ou nitrato de celulose, um material polimérico e explosivo.
Fotocatalítico
O ânion não3-, E, portanto, nitratos inorgânicos, podem ser formados pela ação fotocatalítica do desperdício de óxido de titânio, tio2, Usando como matéria -prima nada mais do que nitrogênio e oxigênio do ar. Este estudo assume que onde há excessos de cara2, haverá quantidades indesejadas de não3-, que afetam a potabilidade da água e podem incluir algas.
Pode atendê -lo: aldeídoFormulários
Cura de carne
 As salsichas são uma das carnes processadas que contêm mais nitratos. Fonte: pxhere.
As salsichas são uma das carnes processadas que contêm mais nitratos. Fonte: pxhere. Os nitratos são adicionados a várias carnes, especialmente salsichas, para eliminar bactérias e, assim, atrasar sua deterioração. Eles também reagem com suas proteínas para dar a elas uma cor mais avermelhada. O problema dessas carnes é que, cozinhando -as em altas temperaturas, elas produzem nitrosoaminas: compostos ligados ao câncer de cólon.
Essa reação é parcialmente evitada se houver vitaminas presentes, como é o caso dos vegetais, que, embora sejam ricos em nitratos, não estão associados a patologias carcinogênicas.
Agricultura
Os nitratos são uma fonte de nitrogênio solúvel. Portanto, serve como fertilizante para contribuir com nitrogênio para as plantas e, portanto, favorece seu crescimento.
Medicamento
Os nitratos têm uma função especial no corpo. Ao assimilar por ação enzimática, é reduzida a óxido nítrico, não. Esta molécula ocupa volume e dilata veias e artérias, permitindo que haja maior fluxo sanguíneo. Portanto, os nitratos são usados como medicamentos para combater as patologias do sistema circulatório.
Irônico e curiosamente, para esse fim nitratos orgânicos, como glicerilo, nitroglicerina, mononitrato isossórida e tetranitrato de pentaeritritol, foram usados, todos bons candidatos no mundo dos explosivos.
Explosivos
Os nitratos são usados em formulações explosivas, sendo a pólvora o exemplo mais simbólico. Sendo agentes oxidantes, eles favorecem a combustão da matéria, além de contribuir para a expansão abrupta do volume devido à liberação de gases após a decomposição.
Exemplos de nitratos
Durante as seções anteriores, mais de um exemplo de nitratos foi mencionado. Finalmente, alguns outros serão listados juntamente com suas respectivas fórmulas e nomes:
-Linho3: Nitrato de lítio
-Rbno3: Nitrato de rubidio
-Mg (não3)2: Nitrato de Magnésio
-SC (não3)2: Scandio Nitrato
-Cr (não3)3: Nitrato de cromo (iii)
-Zn (não3)2: nitrato de zinco
-PB (não3)2: nitrato de chumbo (ii)
-Agno3: nitrato de prata
-CH3CH2OU NÃO2: Nitrato de etila
-CH3(CH2)4OU NÃO2: Amilo nitrato
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Clark J. (5 de junho de 2019). A estabilidade térmica dos nitratos e carbonatos. Química Librettexts. Recuperado de: química.Librettexts.org
- Wikipedia. (2020). Nitrato. Recuperado de: em.Wikipedia.org
- Angela Dowden. (12 de março de 2019). A verdade sobre os nitratos em sua comida. Recuperado de: BBC.com
- Elsevier b.V. (2020). Nitrato. Cientedirect. Recuperado de: ScientEdirect.com
- Dr. BIJI S. & Prof. Govindan v. (26 de abril de 2017). O papel dos nitratos orgânicos no gerenciamento médico ideal da angina. Sociedade Europeia de Cardiologia. Recuperado de: escardio.org
- Yuan, s., Chen, j., Lin, z. et al. (2013). Formação de nitrato a partir de nitrogênio atmosférico e oxigênio fotocatalisado por dióxido de titânio nano-sded. Nat Commun 4, 2249. doi.org/10.1038/NCOMMS3249
- « Fundamentos da terapia narrativa de Michael White, Procedimento, Técnicas
- Nomenclatura de epóxi, obtenção, aplicações, exemplos »

