Nomenclatura de epóxi, obtenção, aplicações, exemplos
- 2233
- 48
- Conrad Schmidt
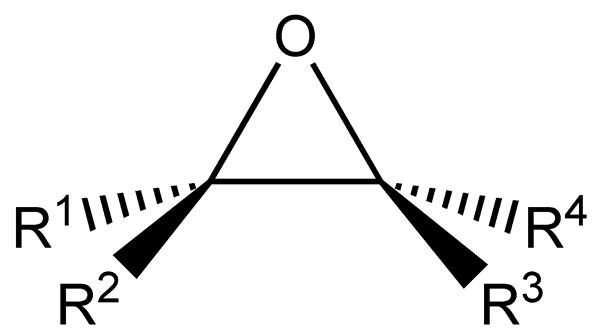
O Epóxidos Eles são hidrocarbonetos alifáticos ou cíclicos que têm um átomo de oxigênio ligado ao mesmo tempo a dois átomos de carbono em sua estrutura. Este link, como visto na imagem inferior, apresenta uma geometria triangular, bastante característica para todos os epóxidos.
Os epóxidos se originam de alcenos que sofrem a ruptura de uma ligação dupla para formar o grupo funcional epóxido. Cada um dos dois átomos ligados ao oxigênio também está ligado a grupos laterais R1, R2, R3 e r4, todas as partes da mesma molécula.
 Fórmula estrutural e geral para epóxidos. Fonte: Tomas Kindahl / Domínio Público.
Fórmula estrutural e geral para epóxidos. Fonte: Tomas Kindahl / Domínio Público. O grupo funcional do epóxido é caracterizado por ter grande tensão, o que confere uma reatividade maior do que a de um éter não cíclico. As reações de epóxido geralmente são acompanhadas pela ruptura de seu grupo funcional.
O epóxido mais simples corresponde ao epóxido de etano, também chamado de óxido de etileno, óxido de etileno ou oxirano. De tudo, este é o epóxido de maior importância comercial.
A maior proporção de produção de epóxido é destinada à pintura (revestimentos de superfície). Eles também são usados na produção de surfactantes, adesivos, plastificantes, etc.
[TOC]
Nomenclatura
Os compostos com o grupo funcional epóxido podem ser chamados de maneiras diferentes, como: epóxi, epóxidos ou outros nomes sem qualquer conotação sistemática, como: oxirano.
Epóxidos com estruturas químicas mais simples são geralmente nomeadas como óxidos. Dessa forma, o epóxido de proponente (c3H6) É chamado de óxido de profeno (c3H6QUALQUER).
É comum ser chamado de epóxido identificando carbonos que estão presentes no grupo funcional epóxido. Por exemplo: 2,3-epoxiexano, 1,2-epoxiciclohexano e 1.2-epoxipropano. Isto é, o "triângulo" é encontrado nos carbonos 2 e 3 do hexano, e assim por diante com a ciclohexana e propano.
Pode servir você: entalpiaObtenção
Oxidação catalítica
O epóxido ethno ou de óxido de etileno é preparado pela oxidação catalítica do etileno em ar quente ou oxigênio, sendo usado como um catalisador de prata de metal:
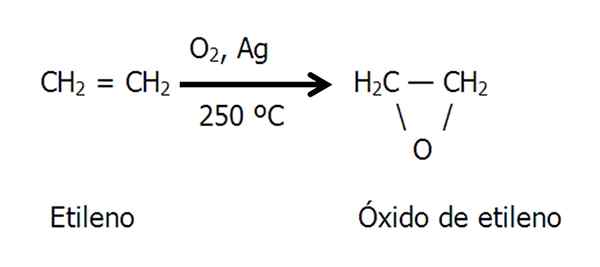 Equação para síntese de óxido de etileno. Fonte: Gabriel Bolívar.
Equação para síntese de óxido de etileno. Fonte: Gabriel Bolívar. Método de clorohidrina
Este método é realizado em dois estágios: a) Formação de cloroidrina e b) Tratamento da cloro -hidrina com base para eliminar o ácido clorídrico.
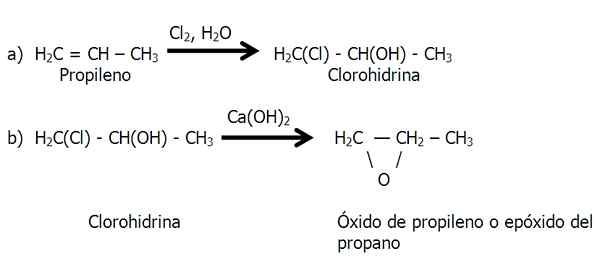 Estágios do método de cloroidrina para síntese de epóxido. Fonte: Gabriel Bolívar.
Estágios do método de cloroidrina para síntese de epóxido. Fonte: Gabriel Bolívar. No estágio b) Uma molécula de HCl está perdida, cujo hidrogênio vem do grupo OH.
Peroxidação de carbono de ligação dupla
Os epóxidos também podem ser formados pela peroxidação de alcenos, ou seja, uma oxidação causada por um bandido, como o ácido peroxibenzóico:
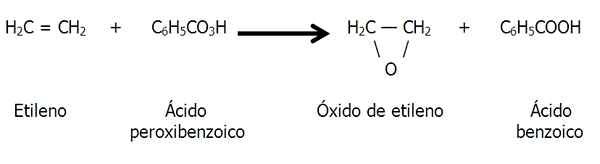 Peroxidação do etileno para formar óxido de etileno ou epóxido de etano. Fonte: Gabriel Bolívar.
Peroxidação do etileno para formar óxido de etileno ou epóxido de etano. Fonte: Gabriel Bolívar. Presença natural de epóxidos
Epóxidos são de natureza incomum. No entanto, a síntese hepática de epóxidos foi observada, mediada pelo citocromo p450. As células produzem epóxidos como produtos de oxidação de alquenos e compostos aromáticos.
Compostos como epotylonas também foram observados na natureza, produzidos como um metabolito secundário das bactérias do Sorângio Celrosum.
Formulários
Preparação de surfactantes
O óxido de etileno é frequentemente usado na preparação de surfactantes ou surfactantes, produtos de reação de álcool ou fenol com óxido de etileno. Os surfactantes cumprem diferentes funções, incluindo: hidratantes, detergentes, emulsificantes e solubilizantes.
Os hidratantes aumentam a hidratação superficial, facilitando o acesso à água a eles. Os detergentes eliminam a sujeira de roupas. Emulsões permitem e estabilizam emulsões. E solubilizantes permitem a dissolução de poucos compostos miscíveis com água.
Pode atendê -lo: Fick LawAdesivos e solventes
A reação de epóxidos, incluindo óxido de etileno, com aminas é a base para a preparação de filas ou gengivas de pasta. Esses adesivos são usados para produzir a união de superfícies, bem como na estabilização do PVC.
O óxido de etileno reage com etoxido de sódio para produzir 2-toxietanol, também conhecido como Celosolve. Este composto químico dissolve óleos, resinas, gorduras, ceras, nitrocelulose e lacas.
Resinas epóxi
As resinas epóxi ou epóxi têm entre suas propriedades, uma vez que foram reforçadas, alta resistência térmica e mecânica. Essas resistências permitem seu uso para a elaboração de lacas e esmaltes, bem como para o revestimento de metais e pisos de laboratório e fabricação de peças elétricas.
Algumas empresas usam essas resinas com enchimentos de sílica substituindo a porcelana para fabricar isoladores de linha elétrica. As resinas epóxi também são usadas para fazer folhas para circuitos impressos e placas reforçadas com fibras de vidro.
As resinas epóxi têm poucos usos separadamente, incluindo estabilidade de vinil. Para aumentar sua utilidade, eles são cruzados com vários compostos em um processo conhecido como "curado". Entre os agentes usados para esse fim, temos: Primariamente, Secundário, Terciário e Poliamidas.
Os epóxidos obtidos de óleos vegetais são usados para síntese de poliomielite, usada na indústria de poliuretano.
Usos médicos
Epotylonas são produtos metabólicos das bactérias Sorângium cellulosum, que têm a propriedade de estabilizar microtúbulos, produzindo assim um bloqueio do ciclo celular.
O uso de ixabepilona, uma epotylonas, foi aprovado para o tratamento de câncer de mama avançado. Da mesma forma, o uso do epotylone D foi estudado no tratamento de Alzheimer.
Pode atendê -lo: ácido dissulfúrico: o que é, estrutura, propriedades, usaOutros usos
O óxido de etileno intervém na síntese de etileno glicol: composto usado como anticongelante em sistemas de resfriamento de carros. O óxido de etileno também é usado na esterilização de materiais e instrumentos médicos.
Toxicidade
A absorção através da pele, inalação ou ingestão de epóxi estão associados à produção de efeitos tóxicos, tanto em animais e animais experimentais quanto. Isso inclui: irritação de tecidos da superfície e sensibilização. Alterações no funcionamento do fígado, células sanguíneas e medula óssea também são produzidas.
Da mesma forma, epóxidos com carcinogenicidade e mutagenicidade foram relacionados a epóxidos. Os eporoxidos, devido à sua alta reatividade eletrofílica e seu caráter de compostos alugados, foram considerados como potenciais agentes carcinogênicos.
Exemplos de epóxias
Finalmente, alguns outros exemplos de epóxis serão listados:
-1.2-epoxipropano
-2,3-epoxyhexan
-1.2-epoxiclohexan
-Óxido de estiramento
-Óxido de isobutileno
-3.4-epoxi-1-butno
Referências
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10º Edição.). Wiley Plus.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison e Boyd. (1987). Quimica Organica. (Quinta edição). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Epóxido. Recuperado de: em.Wikipedia.org
- Leroy g. Wade. (2020). Epóxido. Encyclopædia britannica. Recuperado de: Britannica.com
- Manson m. M. (1980). Epóxidos: existe para o problema de saúde humana? British Journal of Industrial Medicine, 37(4), 317-336. doi.org/10.1136/OEM.37.4.317
- Produtos químicos. (s.F.). Exemplos de epóxias. Recuperado de: química.líquido
- C.G. Oleiro. (1963). A química e o uso de resinas de epóxido, Medicina Ocupacional, Volume 13, Edição 1, abril de 1963, páginas 42-47, doi.org/10.1093/occmed/13.1.42
- Molinero Muñoz, María e Fernández Arberas, Nera. (2016). Epotylonas, uma alternativa no campo do antitumoral. Complutense Madrid University.
- Alejandro Aguirre f. & Lesly espinoza b. (2018). Usos e aplicações de epóxis e sulfídios. Universidade Central do Equador. Recuperado de: Academia.Edu
- « Propriedades de nitratos, estrutura, nomenclatura, treinamento
- Características da reação de Cannizzaro, mecanismos, exemplos »

