Estrutura de nitrato de zinco, propriedades, obtenção, usos

- 2743
- 587
- Terrell Stokes
Ele Nitrato de zinco É um composto inorgânico formado pelos elementos de zinco (Zn), nitrogênio (n) e oxigênio (O) (O). O status de oxidação do zinco é +2, o do nitrogênio é +5 e o oxigênio é -2.
Sua fórmula química é Zn (não3)2. É um cristalino incolor sólido que tende a absorver a água do meio ambiente. Pode ser obtido tratando o metal de zinco com ácido nítrico diluído. É um composto fortemente oxidante.
 Fifr Zn Nitrato (não3)2. Ondřej MANGL / PUB DOMAIN. Fonte: Wikimedia Commons.
Fifr Zn Nitrato (não3)2. Ondřej MANGL / PUB DOMAIN. Fonte: Wikimedia Commons. Serve como um acelerador de reações químicas orgânicas e permite obter polímeros compostos com propriedades de condução de eletricidade. É usado para formar camadas de materiais úteis em eletrônicos.
Faz parte de alguns fertilizantes líquidos e certos herbicidas de liberação lenta. Ajude na preparação de óxidos complexos, melhorando sua densidade e condutividade elétrica.
Foi testado com sucesso na obtenção de estruturas que servem de base para a regeneração e crescimento do tecido ósseo, melhorando esse processo e resultando em um antibacteriano.
Embora não seja combustível, pode acelerar a queima de substâncias, como carvão ou materiais orgânicos. É pele irritante, olhos e membranas mucosas, e é muito tóxico para a vida aquática.
[TOC]
Estrutura
O nitrato de zinco é um composto iônico. Tem um cátion bivalente (Zn2+) e dois ânions monovalentes (não3-). O ânion nitrato é um íon poliiatômico formado por um átomo de nitrogênio em seu estado de oxidação +5 ligado a três átomos de oxigênio com valência de -2.
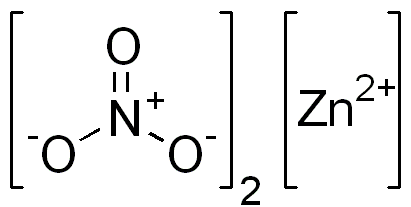 Estrutura de nitrato iônico de zinco. Edgar181 / domínio pub. Fonte: Wikimedia Commons.
Estrutura de nitrato iônico de zinco. Edgar181 / domínio pub. Fonte: Wikimedia Commons. A imagem abaixo mostra a estrutura espacial deste composto. A esfera central cinza é zinco, esferas azuis são nitrogênio e esferas vermelhas representam oxigênio.
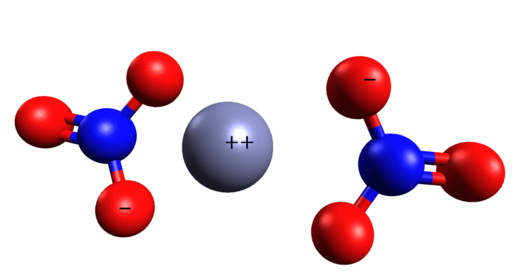 Estrutura espacial de Zn (não3)2. Cinc está no meio de íons nitratos. Grasso Luigi/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Estrutura espacial de Zn (não3)2. Cinc está no meio de íons nitratos. Grasso Luigi/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Nomenclatura
- Nitrato de CINC
- Dinitrato de zinco
Propriedades
Estado físico
Branco sólido ou cristalino incolor.
Peso molecular
189,40 g/mol
Ponto de fusão
Aproximadamente 110 ºC.
Pode atendê -lo: ácido iarhídrico (HI): estrutura, propriedades e usosPonto de ebulição
Aproximadamente 125 ºC.
Densidade
2.065 g/cm3
Solubilidade
Solúvel em água: 120 g/100 g h2Ou a 25 ° C. Álcool solúvel.
ph
Suas soluções aquosas são ácidas. Uma solução de 5% tem um pH de aproximadamente 5.
Propriedades quimicas
Por ser um nitrato, este composto é um oxidante forte. Reage violentamente com carvão, cobre, sulfetos de metal, matéria orgânica, fósforo e enxofre. Se for pulverizado em explorações de carvão quentes.
Por outro lado, é higroscópico e absorve a água do meio ambiente. Se for uma forma de óxido de zinco, nitrogênio e dióxido de oxigênio:
2 Zn (não3)2 + calor → 2 znO + 4 não2↑ + o2↑
Nas soluções alcalinas, como as de NaOH, o zinco deste composto forma seu hidróxido e outras espécies complexas:
Zn (não3)2 + 2 Oh- → Zn (OH)2 + 2 não3-
Zn (OH)2 + 2 Oh- → [Zn (OH)4]2-
Obtenção
Pode ser obtido tratando o zinco ou óxido de zinco com ácido nítrico diluído. O gás de hidrogênio é formado nesta reação.
Zn + 2 hno3 → Zn (não3)2 + H2↑
Formulários
Catálise das reações
É usado como catalisador na obtenção de outros compostos químicos, como resinas e polímeros. É um catalisador ácido.
 Exemplo de resina. Bugman na Wikipedia inglesa / domínio público. Fonte: Wikimedia Commons.
Exemplo de resina. Bugman na Wikipedia inglesa / domínio público. Fonte: Wikimedia Commons.  Modelo de estrutura de polímeros. Ilmari Karonen / Pub domínio. Fonte: Wikimedia Commons.
Modelo de estrutura de polímeros. Ilmari Karonen / Pub domínio. Fonte: Wikimedia Commons. Outro caso de aceleração das reações é o sistema catalítico de Zn (não3)2/Voc2QUALQUER4, que permite a oxidação de α-hidrolistros a α-zo-estresse com 99% de conversão, mesmo com pressão e temperatura ambiental.
Em polímeros compostos
Os filmes de polimetilmetacrilato e Zn foram desenvolvidos (não3)2 com propriedades de condutividade elétrica que os tornam os candidatos apropriados para serem usados em supercauges e computadores de alta velocidade.
Em cimentos oxyst
Com soluções aquosas de nitrato de zinco e pó de óxido de zinco, são obtidos materiais pertencentes à classe de cimentos gerados por uma reação ácido-base.
Estes têm uma resistência razoável à dissolução em ácidos diluídos e álcalis, desenvolvendo compressão de resistência à compressão em comparação com a de outros cimento.
Esta propriedade aumenta quando a relação ZnO/Zn é aumentada (não3)2, E quando a concentração de Zn é carregada (não3)2 Na solução. Os cimentos obtidos são completamente amorfos, ou seja, eles não têm cristais.
Pode atendê -lo: precipitação química Com nitrato de zinco, testes para obter cimentos foram realizados. Autor: Kobthanapong. Fonte: Pixabay.
Com nitrato de zinco, testes para obter cimentos foram realizados. Autor: Kobthanapong. Fonte: Pixabay. Em revestimentos e nanomateriais de óxido de zinco
O Zn (não3)2 É usado para deposição eletrolítica de camadas muito finas de óxido de zinco (ZnO) em vários substratos. Nanoestruturas deste óxido também são preparadas nas superfícies.
 Nanopartículas de óxido de zinco. Algumas nanoestruturas de ZnO podem ser preparadas com Zn (não3)2. Verena Wilhelmi, Ute Fischer, Heike Justardt, Klaus Schulze-Ofroff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC por (https: // CreativeCommons.Org/licenças/por/2.5). Fonte: Wikimedia Commons.
Nanopartículas de óxido de zinco. Algumas nanoestruturas de ZnO podem ser preparadas com Zn (não3)2. Verena Wilhelmi, Ute Fischer, Heike Justardt, Klaus Schulze-Ofroff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC por (https: // CreativeCommons.Org/licenças/por/2.5). Fonte: Wikimedia Commons. O ZnO é um material de grande interesse devido à multidão de aplicações no campo da optoletrônica, também possui propriedades semicondutores e é usado em sensores e transdutores.
Em herbicidas
O nitrato de CINC tem sido usado junto com alguns compostos orgânicos para reduzir a velocidade de liberação de certos herbicidas na água. A liberação lenta desses produtos permite que eles estejam disponíveis para aplicativos mais longos e menos necessários.
Na fabricação de ânod
Estimula o processo de sinterização e melhora a densidade de certos óxidos que servem para fazer ânodas para células de combustível. A sinterização está obtendo um material sólido através do aquecimento e compressão de um pó sem atingir sua fusão.
 Desenhando como ocorre dois grãos de sinterização. O Zn (não3)2 Ajuda na execução desse processo em alguns óxidos complexos. Domínio de cdang / pub. Fonte: Wikimedia Commons.
Desenhando como ocorre dois grãos de sinterização. O Zn (não3)2 Ajuda na execução desse processo em alguns óxidos complexos. Domínio de cdang / pub. Fonte: Wikimedia Commons. Os materiais em que os testes foram realizados são óxidos complexos de estrôncio, irídio, ferro e titânio. A presença de Fal aumenta significativamente a condutividade elétrica destes.
Outros aplicativos
É usado na obtenção de medicamentos. Atua como um mordente na aplicação de tintas e corantes. Serve como coagulante de látex. É uma fonte de zinco e nitrogênio em fertilizantes líquidos.
Uso potencial em engenharia de tecido ósseo
Este composto foi usado como aditivo na elaboração de armaduras ou quadros para a regeneração de fibras ósseas, pois permite melhorar a resistência mecânica dessas estruturas.
Pode atendê -lo: Germanio: história, propriedades, estrutura, obtenção, usaObservou -se que o andaime que contém a quinta não é tóxico para as células osteoprogenitoras, suporta a atividade de osteoblastos que são as células que fabricam ossos e melhoram sua adesão e proliferação.
Favorece a formação de Apatita que é o mineral que forma os ossos e também exerce um efeito antibacteriano.
 O Zn (não3)2 Pode ser muito útil para a reconstrução da matéria óssea em pessoas que sofreram acidentes. Mariano Coretti/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
O Zn (não3)2 Pode ser muito útil para a reconstrução da matéria óssea em pessoas que sofreram acidentes. Mariano Coretti/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Riscos
É um material com risco potencial de incêndio e explosão.
Não é combustível, mas acelera a queima de materiais combustíveis. Se uma grande quantidade desse composto estiver envolvida em um incêndio ou se o material combustível for dividido, poderá ocorrer uma explosão.
Quando submetido a calor forte, óxidos tóxicos de nitrogênio são produzidos. E se a exposição for realizada prolongada, pode explodir.
É irritante para a pele, pode causar sérios danos aos olhos, irritação no trato respiratório, é tóxico devido à ingestão e causa danos ao trato digestivo.
Muito tóxico para a vida aquática com efeitos que duram.
Referências
- Ju e. et al. (2019). Novo efeito do nitrato de zinco/oxalato de vanadil para oxidação catalítica seletiva de ésteres alfa-hidroxi para alfa-ceto com oxigênio molecular: um in situ. Molecules 2019, 24, 1281. MDPI se recuperou.com.
- Mohd s., S.N. et al. (2020). Formulação de liberação controlada de nitrato de hidróxido de zinco intercalado com dodecilsulfe de sódio e ânions bispirribac: um novo nanocompósito de herbicida para cultivo de arroz. Arabian Journal of Chemistry 13, 4513-4527 (2020). Recuperado de cientedirect.
- Homem, m.P. et al. (2019). Resistência mecânica enriquecida e mineralização óssea de andaimes biomiméticos eletroespun carregados com óleo Ylang e nitrato de zinco para engenharia de tecido ósseo. Polímeros 2019, 11, 1323. MDPI se recuperou.com.
- Kim, k.Yo. et al. (2018). Efeitos do nitrato de zinco como um auxílio de sinterização nas características electocímicas de SR0,92E0,08Tio3-delta e Sr0,92E0,08Você0,6Fé0,4QUALQUER3-delta Ceramics International, 44 (4): 4262-4270 (2018). Recuperado de cientedirect.com.
- Prasad, b.E. et al. (2012). Eletrodeposição de revestimento de znO de Zn aquoso (não3)2 Banhos: Efeito da concentração de Zn, deposição de temperatura e tempo na orientação. J Solid State Electochem 16, 3715-3722 (2012). Link recuperado.Springer.com.
- Bahadur, h. e Srivastava, para.K. (2007). Morfologias de filmes finos deriados de sol-gel de ZnO usando diferentes materiais precursores e suas nanoestruturas. NanoScale Res Lett (2007) 2: 469-475. Link recuperado.Springer.com.
- Nicholson, J.C. e Tibaldi, J.P. (1992). Formação e propriedades de cimento preparadas a partir de óxido de zinco e soluções aquosas de nitrato de zinco. J Mater Sci 27, 2420-2422 (1992). Link recuperado.Springer.com.
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- Maji, p. et al. (2015). Efeito de Zn (não3)2 Preenchimento sobre o desmillidade dielétrica e o módulo elétrico de PMMA. Bull Mater Sci 38, 417-424 (2015). Link recuperado.Springer.com.
- OU.S. Biblioteca Nacional de Medicina. (2019). Nitrato de zinco. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Byju's. (2020). Nitrato de zinco - Zn (NO3) 2. Recuperado de Byjus.com.
- Elementos americanos. Nitrato de zinco. Recuperado dos americanos.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- « Estrutura de cloreto de zinco (ZNCL2), propriedades, obtenção, uso
- Casos concretos de processo ético em instituições e organizações »

