Estrutura de cloreto de zinco (ZNCL2), propriedades, obtenção, uso

- 2284
- 358
- Gilbert Franecki
Ele cloreto de zinco É um composto inorgânico formado pelo elemento de zinco ou zinco (Zn) e cloro (CL). Sua fórmula química é ZnCl2. Cinc é encontrado no estado de oxidação +2 e o cloro tem uma valência de -1.
É um sólido cristalino incolor ou branco. É muito solúvel em água e facilmente a absorve do ambiente, que pode ser visto na figura do sólido umedecido mostrado abaixo.
 Cloreto de fifcl2 sólido um pouco hidratado. Usuário: Walkerma / Domínio Público. Fonte: Wikimedia Commons.
Cloreto de fifcl2 sólido um pouco hidratado. Usuário: Walkerma / Domínio Público. Fonte: Wikimedia Commons. O zinco deste composto é biologicamente muito importante para humanos, animais e plantas, pois intervém em funções básicas, como síntese de proteínas e gordura.
Por esse motivo, o ZNCL2 É usado como um complemento nutricional para animais e humanos em casos de deficiência de zinco e como micronutriente para plantas.
Possui propriedades bacteriostáticas e adstringentes e é amplamente utilizado para esses fins em medicina humana e veterinária. Também elimina pragas como fungos ao ar livre e é intermediário para obter pesticidas.
Entre seus múltiplos usos, serve para tratar fibras de celulose e lã em vários processos, bem como para prepará -las para a cor ou a impressão. Também atrasar a combustão de madeira.
[TOC]
Estrutura
O ZNCL2 É um composto iônico formado pelo cátion Zn2+ e dois ânions cloreto cl- que se ligam através das forças eletrostáticas.
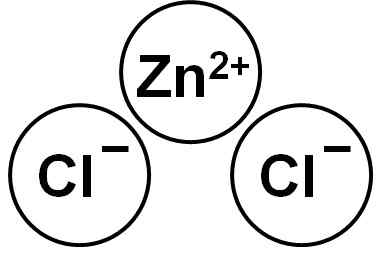 Cloreto de zinco. Autor: Marilú Stea.
Cloreto de zinco. Autor: Marilú Stea. O íon de zinco (ii) tem a seguinte estrutura eletrônica:
1s2, 2s2 2 p6, 3s2 3p6 3d10, 4s0,
em que observa -se que ambos os elétrons da capa 4s, em que a configuração é estável.
O íon cloreto apresenta a seguinte estrutura:
1s2, 2s2, 2 p6, 3s2 3p6,
o que também é muito estável por ter orbitais completos.
Na figura, a maneira pela qual os íons estão disponíveis no vidro pode ser observado. Esferas cinzas representam zinco e esferas verdes para cloro.
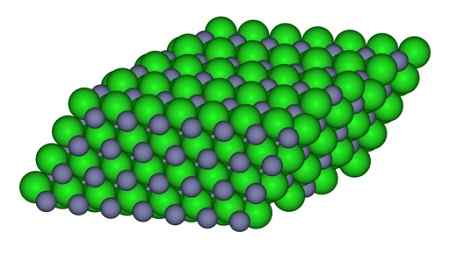 Estrutura que forma os íons no cristal de ZnCl2. CCoil/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Estrutura que forma os íons no cristal de ZnCl2. CCoil/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. Nomenclatura
- Cloreto de zinco (ii)
- Dicloreto de zinco
Propriedades
Estado físico
Branco sólido ou cristalino incolor. Cristais hexagonais.
Peso molecular
136,3 g/mol
Ponto de fusão
290 ºC
Ponto de ebulição
732 ºC
Densidade
2.907 g/cm3 a 25 ° C
Solubilidade
Muito solúvel em água: 432 g/100 g h2Ou a 25 ° C, 614 g/100 g de H2Ou 100 ° C. Muito solúvel em ácido clorídrico (HCl), álcool e glicerol. Totalmente miscível.
Pode atendê -lo: Hidróxido de Mercúrio: Estrutura, Propriedades, Usos, Riscosph
Suas soluções aquosas são ácidas. Uma solução de 6 moles de ZnCl2/L tem um pH de 1,0.
Propriedades quimicas
É um composto higroscópico e delicado, porque em contato com a umidade do ambiente, ele absorve muita água. Na água, é hidrolisado e tem a tendência de formar um insolúvel básico de oxicloreto de zinco.
Reage com óxido de zinco (ZnO) em oxicloretos de zinco que geram água que constituem um material de cimento do tipo extremamente duro.
É gentilmente corrosivo em relação aos metais.
Não é inflamável.
Papel biológico
O zinco biologicamente é um dos elementos mais importantes. Foi reconhecido como essencial para todos os modos de vida.
No corpo humano, o ZNCL2 O Zn fornece, essencial para a proteína, colesterol e síntese de gordura. Particularmente CINC é importante para o funcionamento adequado do sistema imunológico.
 O znCl de zinco2 É importante para a divisão celular nos seres vivos. Ladyofhats / domínio público. Fonte: Wikimedia Commons.
O znCl de zinco2 É importante para a divisão celular nos seres vivos. Ladyofhats / domínio público. Fonte: Wikimedia Commons. Mais de 25 proteínas contendo zinco foram identificadas, e muitas delas são enzimas, necessárias na divisão e crescimento celular e para a liberação de vitamina A do fígado.
A deficiência de CINC pode levar ao crescimento do crescimento, função mental deprimida, anorexia, dermatite, diminuição da imunidade, diarréia e visão noturna ruim, entre outras condições.
Obtenção
Comercialmente este composto é preparado reagindo ácido clorídrico aquoso com sucata, resíduos de zinco ou com o mineral que o contém. Nesta reação, também há hidrogênio a gás (h2).
O tratamento de zinco com cloreto de hidrogênio a 700 ° C é obtido.
Zn + HCl → ZnCl2 + H2↑
Formulários
Em tratamentos terapêuticos
É um antibacteriano macio ou bacteriostático, por isso é usado em chuvas vaginais para eliminar tricomonas ou infecções por Haemophilus. Também serve para tratar calos, como adstringente e quimiocirgia no câncer de pele.
É usado como adstringente em alguns cosméticos, como loções refrescantes para a pele.
Como suplemento nutricional
Devido à sua importância em várias funções do organismo humano, o ZNCL2 É administrado por via oral como parte dos acessórios nutricionais e também em pessoas que precisam de comida parenteral.
Suplementos ZNCL2 Eles são fornecidos para tratar a zona.
Pode servir você: mistura homogênea Suplementos ZNCL2 Eles devem ser usados quando houver deficiência de zinco. Autor: Moakets. Fonte: Pixabay.
Suplementos ZNCL2 Eles devem ser usados quando houver deficiência de zinco. Autor: Moakets. Fonte: Pixabay. Indivíduos saudáveis o adquirem através da comida.
Deve ser fornecido pelo menos 1 hora antes das refeições ou 2 horas depois delas, pois alguns alimentos podem impedir sua absorção. Em pacientes com irritação estomacal após a ingestão de suplementos, deve ingeri -la com refeições, mas assim o zinco será menos biodisponível.
Em aplicações veterinárias
Suas soluções têm sido usadas em animais como agente cáustico para queimar ou caulores fístulas, que são conexões entre órgãos que não são normais ou saudáveis; na forma de massas serve para tratar úlceras e quimioterapia contra o câncer.
 As soluções aquosas do ZNCL2 Eles são usados para tratar infecções por olhos de animais. Autor: Mabel Amber. Fonte: Pixabay.
As soluções aquosas do ZNCL2 Eles são usados para tratar infecções por olhos de animais. Autor: Mabel Amber. Fonte: Pixabay. Nas infecções oculares, uma solução muito diluída desse composto atua como um anti -séptico e adstringente.
Também é usado como vestígios na alimentação animal ou como um suplemento alimentar.
Em cimentos especiais
A reação entre o ZNCL2 E o ZnO em água produz algum oxicloreto de zinco que compõe um material extremamente difícil ou de cimento. Os principais constituintes são 4ZNO • ZNCL2• 5h2O e ZnO • ZNCL2• 2h2QUALQUER.
Este tipo de cimentos resiste ao ataque de ácido ou água fervente. No entanto, o penta -hidrato é muito estável e insolúvel, mas imutável, e o di -hidrato é mais solúvel e pode causar drenagem líquida.
Por esses motivos, esses cimentos têm poucas aplicações.
Como catalisador
Serve para acelerar algumas reações químicas orgânicas. Atua como um agente condensador. Por exemplo, em reações aldólicas, reações de amação e reações de adição de ciclo. Em alguns desses atos como um iniciador radical.
É um ácido de Lewis e catalisa as reações de Diels-Alder. Também é usado como catalisador em reações de Friedel-Crafts, para fabricar corantes e corantes e na fabricação de resinas políticas políticas.
Abaixo está uma reação em que este composto intervém:
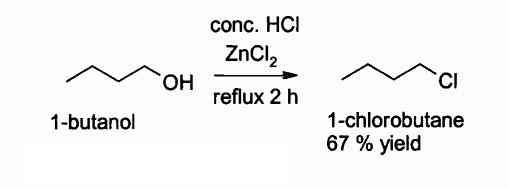 Reação de obter um cloreto de alquil usando ZNCL2. Autor: Walkerma. Fonte: Wikimedia Commons.
Reação de obter um cloreto de alquil usando ZNCL2. Autor: Walkerma. Fonte: Wikimedia Commons. Em atividades agrícolas
Foi usado como herbicida nas culturas, como tratamento foliar, para eliminar pragas como fungos e musgo, e como um micronutriente. É intermediário preparar pesticidas.
Em aplicações odontológicas
É usado em lavagens na boca, no entanto, o tempo de contato recomendado é muito curto, por isso atua apenas como um adstringente na mucosa oral. Serve como dessensibilizador, é usado em pastas dentadas e faz parte de cimentos dentários.
Pode atendê -lo: clorito de sódio (naclo2): estrutura, propriedades, usos, riscosNa indústria têxtil e de papel
É um ingrediente do solvente usado na fabricação de rayon ou seda artificial da celulose. É um agente de reticulação ou sindicato para resinas terminando em têxteis. Também serve para tratá -los e favorecer sua conservação.
Ele permite enrolar tecidos, separar fibras de seda e lã e atua como um mordente na impressão e coloração de têxteis.
É usado na fabricação de rolos de papel e para produzir papel crepe.
Na preparação de nanopartículas
Reagindo cloreto de zinco com sulfeto de sódio (NA2S) Através de um método sonoquímico e na presença de certos compostos orgânicos nanopartículas de sulfeto de zinco (ZNS) são obtidos. Métodos sonoquímicos usam ondas sonoras para causar reações químicas.
Esse tipo de nanomateriais pode ter aplicação como agentes fotocatalíticos para produzir, por exemplo, a divisão da água em seus componentes (hidrogênio e oxigênio) pela ação da luz.
Em várias aplicações
- Desodorante, anti -séptico e desinfetante de áreas. Moss, controle de mofo e fungos em estruturas e áreas adjacentes externas, como calçadas, pátios e cercas. Desinfetante de banheiros, urinária, tapetes e madeira comprimida.
- Usado em misturas para embalsmar e soluções para a conservação de espécimes anatômicos.
- Retardador de chama de madeira.
- Ingrediente primário em bombas de fumaça usadas para dispersar uma infinidade de pessoas; Os bombeiros os usam em exercícios e práticas de combate a incêndio.
 O cloreto de CINC é usado em bombas de fumaça usadas em exercícios militares. OU.S. Departamento de Defesa PhotoSCPL atual. Abraham Lopez / 2ª Divisão Marinha / Domínio Público. Fonte: Wikimedia Commons.
O cloreto de CINC é usado em bombas de fumaça usadas em exercícios militares. OU.S. Departamento de Defesa PhotoSCPL atual. Abraham Lopez / 2ª Divisão Marinha / Domínio Público. Fonte: Wikimedia Commons. - Componente de fluxo de soldagem. Na gravação de metal. Para coloração de aço, componente de banheiro de folheado galvanizado e de ferro com cobre.
- Em cimentos de magnésio e cimento de metal.
- Para quebrar emulsões no refinamento de petróleo. Agente na fabricação de asfalto.
- Eletrólito em baterias secas.
 Bateria de ZnCl seca2. Usuário: 32bitmaschine; Editado pelo usuário JayBear/CC BY-S (https: // criativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Bateria de ZnCl seca2. Usuário: 32bitmaschine; Editado pelo usuário JayBear/CC BY-S (https: // criativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. - Vulcanização da borracha.
- Agente desidratante.
Riscos
Pode causar queimaduras nos olhos, pele e membranas mucosas.
Quando aquecido em sua decomposição emite cloreto de hidrogênio tóxico (HCL) e óxido de zinco (ZnO).
Aviso sobre seu uso como uma droga
Embora os estudos conclusivos estejam ausentes, estima -se que, se este composto for administrado a mulheres grávidas, isso pode causar danos ao feto. Mas os benefícios potenciais podem ter mais peso do que possíveis riscos.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Zinco de cloreto. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Liska, m. et al. (2019). Cimento especial. Cimento de oxicloreto de zinco. Na química de Lea de cimento e concreto (quinta edição). Recuperado de cientedirect.
- Pohanish, r.P. (2017). Zinco de cloreto. No manual de produtos químicos tóxicos e perigosos de Sittig e carcinágenos (sétima edição). Recuperado de cientedirect.com.
- Gedanken, a. e perelshtein, eu. (2015). Ultrassom de energia para a produção de nanomateriais. No poder ultrassonsonics. Recuperado de cientedirect.
- Archibald, s.J. (2003). Grupos de metal de transição 9-12. Reações e catálise. Na compreensão da coordenação química II. Recuperado de cientedirect.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- « Estrutura de cromato de zinco, propriedades, obtenção, usa
- Estrutura de nitrato de zinco, propriedades, obtenção, usos »

