Estrutura de nitrato de sódio (nano3), propriedades, usos, riscos

- 3437
- 199
- Dennis Heidenreich
Ele nitrato de sódio É um sólido inorgânico cristalino formado por um íon de sódio+ e um íon nitrato não3-. Sua fórmula química é nano3. Na natureza, é encontrado como mineral de nitratina ou nitratita, que está em abundância no deserto de Atacama no Chile, então esse mineral também é chamado de Salitre de Chile ou Caliche.
O nitrato de sódio é um sólido não combustível, mas pode acelerar a oxidação ou a queima de materiais inflamáveis. Por esse motivo, ele tem amplo uso em fogos de artifício, em explosivos, em fósforos, em tijolos de carvão e em alguns tipos de pesticidas, para eliminar roedores e outros pequenos mamíferos.
 Nitratina ou nitratita, mineral de nitrato de nano sódio3. John Sobolewski (JSS) [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons.
Nitratina ou nitratita, mineral de nitrato de nano sódio3. John Sobolewski (JSS) [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons. A capacidade de favorecer a combustão ou ignição de outros materiais significa que deve ser manipulado com grande cautela. Se for exposto a chamas ou incêndios, pode explorar. Apesar disso o nano3 É usado na indústria de alimentos porque possui propriedades conservantes, especialmente carnes e alguns tipos de queijos.
No entanto, seu excesso de ingestão pode causar problemas de saúde, especialmente em mulheres grávidas, bebês e crianças. Ao se transformar em nitritos no sistema digestivo, pode causar certas doenças.
[TOC]
Estrutura química
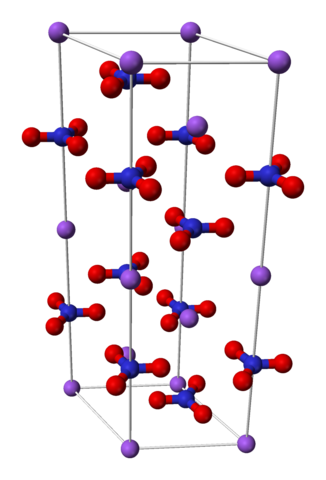 Nano3 Romboédrica UNITY CELL. Fonte: Benjah-BMM27 [Domínio Público]
Nano3 Romboédrica UNITY CELL. Fonte: Benjah-BMM27 [Domínio Público] O nitrato de sódio é composto de um cátion de sódio+ e um ânion nitrato não3-.
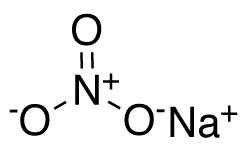 Nano de nano de sódio3. CCROBERTS [domínio público]. Fonte: Wikimedia Commons.
Nano de nano de sódio3. CCROBERTS [domínio público]. Fonte: Wikimedia Commons. No ânion nitrato não3- Nitrogênio N tem uma valência de +5 e oxigênio uma valência de -2. Por esse motivo, o ânion nitrato tem uma carga negativa.
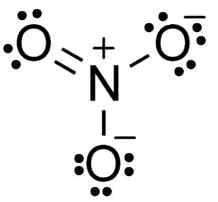 Estrutura de nitrato de íons lewis. TEM5PSU [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Estrutura de nitrato de íons lewis. TEM5PSU [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. O ânion não3- Possui uma estrutura plana e simétrica, na qual os três oxygens distribuem da maneira negativa ou uniforme.
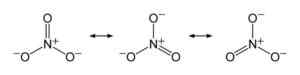 No íon nitrato, a carga negativa é distribuída igualmente entre os três átomos de oxigênio. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
No íon nitrato, a carga negativa é distribuída igualmente entre os três átomos de oxigênio. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Nomenclatura
-Nitrato de sódio
-Nitrato de sódio
-Saltpeter de sódio (inglês Saltpeter de sódio)
-Nitro refrigerante (inglês Soda Nitre)
-Salitre de Chile
-Nitrato chileno
-Nitratina
-Nitratita
-Caliche
Propriedades
 Cristais romboédicos de nitrato de sódio obtidos de uma solução supersaturada. Fonte: Vadim Sedov [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)]
Cristais romboédicos de nitrato de sódio obtidos de uma solução supersaturada. Fonte: Vadim Sedov [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)] Estado físico
Cor incolor a brancos, trigonais ou cristais rompidos.
Peso molecular
84.995 g/mol
Ponto de fusão
308 ºC
Ponto de ebulição
380 ºC (decompõe).
Densidade
2.257 g/cm3 A 20 ºC.
Solubilidade
Solúvel em água: 91,2 g/100 g de água a 25 ºC ou 1 g em 1,1 ml de água. Ligeiramente solúvel em etanol e metanol.
ph
As soluções de nitrato de sódio são neutras, ou seja, nem ácido nem básico, portanto, seu pH é 7.
Outras propriedades
É um sólido higroscópico, ou seja, absorve a água do ambiente.
 Nano de nano de sódio3 sólido. Ondřej Mangl [Domínio Público]. Fonte: Wikimedia Commons.
Nano de nano de sódio3 sólido. Ondřej Mangl [Domínio Público]. Fonte: Wikimedia Commons. Sua dissolução de água faz com que a solução esfrie, por isso diz -se que esse processo de dissolução é endotérmico, em outras palavras, ao dissolvê -lo absorve o calor do ambiente e, portanto, a solução esfria.
Pode atendê -lo: carbono primário: características, tipos e exemplosA temperaturas muito baixas, o nitrato de sódio é solúvel em amônia líquida NH3, formando nano3· 4NH3 Abaixo -42 ºC.
Nano3 Não é combustível, mas sua presença acelera a combustão de materiais ou compostos que são. Isso ocorre porque quando é aquecido, oxigênio ou2, entre outros gases.
Obtenção
É obtido principalmente por extração dos depósitos minerais ou minas de salitre do chile (caliche ou nitratita). Para isso, a salmoura é usada e depois a cristalização e a recristalização são realizadas para obter nano cristais3 Purest.
Essas minas estão principalmente na América do Sul, no norte do Chile, no deserto de Atacama. Está associado ao nitrato de potássio3 e para decomposição da matéria orgânica.
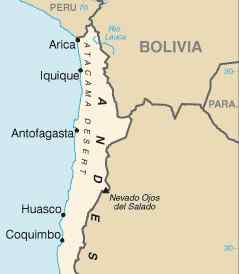 Localização do deserto de Atacama no norte do Chile, onde há importantes depósitos de nitrato de sódio. CIA [domínio público]. Fonte: Wikimedia Commons.
Localização do deserto de Atacama no norte do Chile, onde há importantes depósitos de nitrato de sódio. CIA [domínio público]. Fonte: Wikimedia Commons. Também pode ser obtido reagindo ácido nítrico com carbonato de sódio na2Co3 ou com hidróxido de sódio Naoh:
2 hno3 + N / D2Co3 → 2 nano3 + Co2↑ + h2QUALQUER
Presença no organismo humano
O nitrato de sódio pode entrar no organismo humano através de alimentos e água que a contém.
60-80% do nitrato ingerido vem de frutas e vegetais. Uma segunda fonte são carnes curadas. A indústria de carne o usa para evitar o crescimento de micróbios e reter a cor.
No entanto, uma alta proporção do nitrato presente no corpo humano vem de sua síntese endógena ou devido a processos dentro do organismo.
Formulários
Na indústria de alimentos
É usado como conservante de alimentos, como agente de cura para carnes em conserva e como um agente de retenção de cores para carnes. Alimentos que podem conter são bacon, salsichas, presunto e alguns queijos.
 Carnes curadas que provavelmente contêm nitrato de sódio. Autor: Falco. Fonte: Pixabay.
Carnes curadas que provavelmente contêm nitrato de sódio. Autor: Falco. Fonte: Pixabay. Em fertilizantes
O nitrato de sódio é usado em misturas de fertilizantes, para fertilizar tabaco, algodão e legumes.
 Trator fertilizando uma plantação. Autor: Franck Barske. Fonte: Pixabay.
Trator fertilizando uma plantação. Autor: Franck Barske. Fonte: Pixabay. Como promotor ou lisonjeira de combustão ou explosão
Nano3 É usado como oxidante em muitas aplicações. É um rico em oxigênio sólido que facilita o processo de ignição através da produção de ou2.
A presença do nano3 faz com que os materiais não requerem oxigênio de fontes externas para acender porque isso suprimentos suficiente2 Quanto às reações exotérmicas auto -sustentadas (geradores de calor) que ocorrem durante a inflamação ou explosão.
Ele tem sido usado há muito tempo como o principal oxidante em materiais pirotécnicos (fogos de artifício), como componente oxidante em explosivos e agentes ou explosões de detonação e como agente propulsor.
Pode atendê -lo: composto químico Fogos de artifício. Em sua composição, há nano nitrato de sódio3. Autor: Usingplaid. Fonte: Pixabay.
Fogos de artifício. Em sua composição, há nano nitrato de sódio3. Autor: Usingplaid. Fonte: Pixabay. Também é usado para melhorar a combustão de tijolos de carvão (briquetas), para favorecer a ignição nas partidas e até para melhorar as propriedades combustíveis do tabaco.
Para eliminar roedores e outros mamíferos
É usado para um tipo especial de pesticidas. As composições que o contêm são fumigantes pirotécnicos que são colocados e queimados em tocas liberando doses letais de gases tóxicos.
Por esse motivo, é usado para o controle de vários roedores, marmotas, coiotes e gambás, em campos abertos, pastagens, áreas não cultivadas, Céspedes e campos de golfe.
Na preparação de outros compostos
É usado na fabricação de ácido nítrico HNO3, Nano de nano de sódio2, e também atua como um catalisador na preparação do ácido sulfúrico H2SW4.
É usado na fabricação de óxidos nitrosos n2O e como um agente oxidante na fabricação de compostos farmacêuticos.
Na extração de metais de resíduos eletrônicos
Certos pesquisadores descobriram que o nano3 Facilita a extração não poluente de metais contidos em equipamentos eletrônicos (telefones celulares, tablets, computadores, etc.).
Os metais úteis que podem ser extraídos dos componentes desses equipamentos eletrônicos são Nickel Ni, Cobalt Co, Manganês MN, Zinc Zn, cobre CU e alumínio.
A extração é feita usando apenas uma solução nano3 e um polímero. E um rendimento de 60% é atingido.
Dessa forma, o lixo eletrônico pode ser reciclado contribuindo para a minimização dos resíduos e a recuperação estável dos recursos.
Em pesquisa sobre saúde e exercício
Segundo alguns estudos, a ingestão de suplementos de nano3 ou alimentos que o contêm naturalmente têm efeitos positivos em relação à saúde. Alguns dos alimentos ricos em nitratos são beterraba, espinafre e rúcula.
Entre os efeitos está melhorar o sistema cardiovascular, reduzir a pressão arterial, melhorar o fluxo sanguíneo e aumentar a quantidade de oxigênio nos tecidos que estão sendo exercidos fisicamente.
Isso indica que o uso de nano pode ser considerado3 como um medicamento de baixo custo na prevenção e tratamento de pacientes com problemas de pressão arterial.
Além disso, pode servir como ajuda eficaz e natural para aumentar a potência muscular em atletas.
Em vários usos
 Pôster de publicidade do século XX, incitando pagar o terreno com o nitrato do Chile. David Perez [domínio público]. Fonte: Wikimedia Commons.
Pôster de publicidade do século XX, incitando pagar o terreno com o nitrato do Chile. David Perez [domínio público]. Fonte: Wikimedia Commons. É usado como oxidante e agente fundador na fabricação de óculos e esmaltes para cerâmica. Também é usado em cimentos especiais.
Serve como um agente químico na recuperação de estanho do lixo -metal, na coagulação do látex, na indústria nuclear e no controle da corrosão em sistemas aquosos.
Pode atendê -lo: disposio: estrutura, propriedades, obtenção, usosRiscos
Perigos de sua manipulação
Tem a propriedade de acelerar a combustão de materiais inflamáveis. Se você estiver envolvido em um incêndio, uma explosão pode ocorrer.
Quando exposto ao calor ou fogo, pode ser explorado, a produção de óxidos tóxicos de nitrogênio.
Problemas relacionados à sua ingestão de comida ou água
Nitrato quando ingerido pode se tornar nitrito tanto na boca quanto no estômago e no intestino.
O nitrito ao reagir com as aminas presentes em alguns alimentos pode se tornar nitrosamina em um meio ácido, como no estômago. A nitrosamina é carcinogênica.
No entanto, isso não acontece quando frutas e vegetais que contêm nitratos estão ingutados naturalmente.
Segundo alguns estudos, a presença de altos níveis de nitrato pode produzir um distúrbio sanguíneo que faz com que o oxigênio seja efetivamente liberado nos tecidos.
Isso pode ocorrer em bebês cuja fórmula de laticínios é preparada com água contendo nitratos.
Também foi observado que altos níveis de nitrato podem gerar problemas na gestação de bebês, causando abortos espontâneos, nascimentos prematuros ou defeitos no tubo neural de fetos.
Recentemente, verificou-se que o nitrato de sódio pode significar um risco para o desenvolvimento do sistema musculoesquelético e a comunicação nervosa-muscular é afetada em humanos.
Nitrato de sódio em alimentos
 O nitrato de sódio é encontrado como aditivo em bacon e outros produtos de carne. Fonte: Cookbookman17 via Flickr (https: // www.Flickr.com/fotos/[email proteger]/6175755733)
O nitrato de sódio é encontrado como aditivo em bacon e outros produtos de carne. Fonte: Cookbookman17 via Flickr (https: // www.Flickr.com/fotos/[email proteger]/6175755733) O nitrato de sódio é sinônimo de carnes, porque, juntamente com o nitrito, eles são adicionados a eles com o objetivo de conservá -los e melhorar sua aparência e sabores. Por sua causa, consumo excessivo de carnes (perrocalientes, bacon, presunto, peixe defumado, etc.) esteve envolvido no link perturbador de cânceres em todo o sistema digestivo.
Embora a relação entre carne tratada com sais de nitrato de nitrito e câncer não seja absoluta, é recomendável moderar sua ingestão.
Por outro lado, legumes (cenouras, beterraba, rabanete, alface, espinafre, etc.) Eles são ricos em nano3 Desde que eles o absorveram de solos de cultivo devido à sua ação de fertilizantes. A ingestão desses vegetais, ao contrário da de produtos à carne, não está ligada a doenças citadas.
Isso se deve a dois motivos: a diferença nos níveis de proteína desses alimentos e a maneira como eles cozinham. Carnes ao fritar ou aquecer a chama promove a reação entre nitratos-nitritos com certos grupos de aminoácidos, para produzir nitrosoaminas: agentes carcinogênicos verdadeiros.
O conteúdo da vitamina C, fibra e polifenóis em vegetais reduz a formação dessas nitrosoaminas. É por isso que o nano3 Por si só, não é uma ameaça à comida.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Nitrato de sódio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Vch verlagsgellschaft mbh.
- Pouretal, h.R. e Ravanbod, M. (2015). Estudo cinético de mg/nano3 pirotecnica usando técnica não-Oosseathermal TG/DSC. J Therm Anal Calim (2015) 119: 2281-2288. Link recuperado.Springer.com.
- Jarosz, J. et al. (2016). O nitrato de sódio diminui. BMC Farmacologia e Toxicologia (2016) 17:20. Recuperado de BMCpharmacoltoxicol.BiomedCentral.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Prival, m.J. (2003). Câncer. Carbinagens na cadeia alimentar. Na Enciclopédia de Ciências Alimentares e Nutrição (Segunda Edição). Recuperado de cientedirect.com.
- Zakhodyaeva, e.PARA. et al. (2019). Extração complexa de metais em um sistema bifásico aquoso baseado em poli (óxido de etileno) 1500 e nitrato de sódio. Molecules 2019, 24, 4078. MDPI se recuperou.com.
- Clements, W.T. et al. (2014). Ingestão de nitrato: uma revisão dos efeitos de saúde e desempenho físico. Nutrients 2014, 6, 5224-5264. MDPI se recuperou.com.
- « 6 vantagens e desvantagens das apresentações digitais
- Evolução da manutenção industrial da origem até o presente »

