Estrutura de nitrato de chumbo, propriedades, obtenção, usa

- 2486
- 365
- Pete Wuckert
Ele nitrato de chumbo o Nitrato de chumbo (II) é um composto inorgânico formado por elementos de chumbo (PB), nitrogênio (n) e oxigênio (O). O chumbo é encontrado como ION PB2+ E nitrogênio e oxigênio formam o íon nitrato3-.
Sua fórmula química é Pb (não3)2. É um sólido cristalino branco muito solúvel em água, onde forma íons Pb2+ e não3-. Também é conhecido como nitrato de plumbose porque o chumbo está em seu menor estado de oxidação.
 Nitrato de chumbo sólido. Ondřej MANGL / PUB DOMAIN. Fonte: Wikimedia Commons.
Nitrato de chumbo sólido. Ondřej MANGL / PUB DOMAIN. Fonte: Wikimedia Commons. Ele tem propriedades fortemente oxidantes, por isso é usado em aplicações onde essa característica é necessária, como na preparação de vários compostos orgânicos e como um reagente de laboratório.
No passado, era amplamente usado para preparar cores de chumbo, onde também atuava como um fixador das cores nos tecidos. Este aplicativo foi abandonado devido à toxicidade de condução.
Foi usado na indústria metalúrgica de várias maneiras e, recentemente, sua utilidade foi encontrada para se formar, juntamente com outros compostos, materiais com altas capacidades de absorção de luz e transformação disso em eletricidade.
No entanto, é uma substância perigosa porque pode favorecer a geração de incêndio. Também é tóxico para o ser humano, animais e plantas, por isso nunca deve ser descartado no ambiente.
[TOC]
Estrutura
É um composto iônico formado por um cátion PB2+ E dois ânions não3-. No nitrato de oxigênio do ânion são dispostos simetricamente em torno de nitrogênio e ligação dupla alternativa com isso.
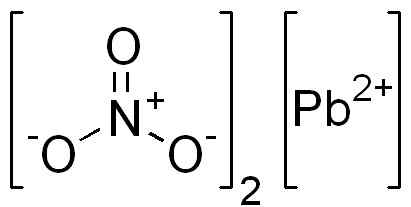 Estrutura PB (não3)2. Edgar181 / domínio pub. Fonte: Wikimedia Commons.
Estrutura PB (não3)2. Edgar181 / domínio pub. Fonte: Wikimedia Commons. 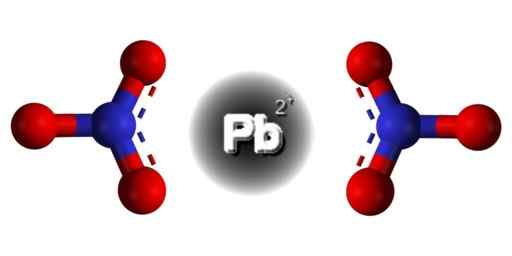 Estrutura espacial de Pb (não3)2. Cinza = chumbo; azul = nitrogênio; Vermelho = oxigênio. Claudio Pistilli/CC BY-S (https: // criativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Estrutura espacial de Pb (não3)2. Cinza = chumbo; azul = nitrogênio; Vermelho = oxigênio. Claudio Pistilli/CC BY-S (https: // criativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. O chumbo neste composto possui a seguinte configuração eletrônica:
[XE] 4F14 5d10 6s2 6p0, onde é observado que perdeu os 2 elétrons da última camada.
Pode atendê -lo: qual é o elemento mais eletronegativo e por quê?Nomenclatura
- Nitrato de chumbo
- Nitrato de chumbo (II)
- Nitrato de plumboso
- Dinitrato de chumbo
Propriedades
Estado físico
Sólido cristalino branco ou incolor. Cristais cúbicos.
Peso molecular
331 g/mol
Ponto de fusão
470 ºC. De acordo com algumas fontes, ele se decompõe nesta temperatura.
Densidade
4,53 g/cm3
Solubilidade
Muito solúvel em água: 59,7 g/100 ml de água a 25 ° C. Ligeiramente solúvel em etanol. Insolúvel em ácido nítrico (HNO3) concentrado.
ph
Uma solução aquosa com 20% de Pb (não3)2 Tem um pH de 3,0-4.0.
Propriedades quimicas
É um agente oxidante. Reage violentamente com materiais e redutores combustíveis.
Não é combustível, mas pode acelerar a queima de materiais que são. Se você esquentar sua decomposição, emite gases tóxicos de óxido de nitrogênio:
2 PB (não3)2 + calor → 2 pbo + 4 não2↑ + o2↑
Ao se dissolver na água, é ionizado:
PB (não3)2 + H2O → pb2+ + 2 não3-
Obtenção
Pode ser preparado reagindo chumbo metálico, monóxido de chumbo (PBO) ou carbonato de chumbo3 Com ácido nítrico. É conveniente usar excesso de ácido para evitar nitratos básicos.
PBO + 2 HNO3 (concentrado) → Pb (não3)2↓+ h2QUALQUER
Formulários
Em orgânico
Sua capacidade de oxidação tem aplicação na preparação de vários compostos.
Foi usado para sintetizar Calixarenos, que são compostos orgânicos cuja molécula tem a forma de uma cesta que permite abrigar outras substâncias, dependendo do uso que será dado a ele.
Serve para obter isotiocianos (R-CS) a partir de aminas (R-NH2).
É usado em escala industrial para preparar o benzaldeído oxidante de cloreto de benchilo. Também serve como um catalisador para a esterificação de compostos orgânicos, por exemplo, para obter poliésteres.
Em análise química
É usado como reagente na determinação do alumínio e chumbo em minerais e rochas.
Na coloração das fibras têxteis
Alguns corantes cromados requerem o uso de pb (não3)2 obter. Por exemplo, para tingir algodão amarelo, é coberto com nitrato de chumbo e é tratado com sulfato de sódio para produzir sulfato de chumbo.
Pode atendê -lo: peso equivalenteEm seguida, uma solução diluída de dicromato de sódio é aplicada para formar cromato de chumbo (pbcro4) Esse é um pigmento amarelo.
 Há um tempo atrás, os tecidos amarelos eram coloridos com pigmentos cujo ponto de partida era Pb (não3)2. Isso não é feito por toxicidade de chumbo. Autor: empresa de produção de animação 3D. Fonte: Pixabay.
Há um tempo atrás, os tecidos amarelos eram coloridos com pigmentos cujo ponto de partida era Pb (não3)2. Isso não é feito por toxicidade de chumbo. Autor: empresa de produção de animação 3D. Fonte: Pixabay. No entanto, hoje os pigmentos de chumbo para sua toxicidade foram parados de usar.
Ele também atua como um mordente para consertar os corantes durante a cor ou a impressão de outros tipos de fibra.
Em Medina Veterinary
Foi usado anteriormente como agente cáustico no tratamento de Chancros ou Gangrenas em cavalos.
Na indústria de metal
O nitrato de chumbo é usado no refinamento eletrolítico de chumbo, como agente para favorecer a flutuação na remoção do titânio de certas argilas, permite recuperar metais preciosos de soluções de cianeto e é usado no eletrodo PBO2 em ânodos de níquel.
Em células solares
Foi usado na forma de solução aquosa para fazer células solares baseadas em perovskita, um mineral de óxido de titânio.
O material sintetizado é um organometálico ou pervskita de iodeto de chumbo que chamou a atenção dos pesquisadores, pois possui uma alta capacidade de absorção de luz e um grande comprimento de difusão dos portadores de carga.
Essas características o tornam um excelente candidato para dispositivos fotovoltaicos, ou seja, eles transformam luz em corrente elétrica.
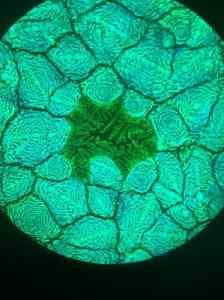 Microfotografia da estrutura da unavskita de halogeneto de chumbo tomado com microscópio de fluorescência. Furava/CC por (https: // criativeCommons.Org/licenças/por/4.0). Fonte: Wikimedia Commons.
Microfotografia da estrutura da unavskita de halogeneto de chumbo tomado com microscópio de fluorescência. Furava/CC por (https: // criativeCommons.Org/licenças/por/4.0). Fonte: Wikimedia Commons. Outros aplicativos
Ele (Pbno3)2 Também foi usado:
- Na fabricação de fósforos, certos explosivos e materiais pirotécnicos,
- Na fotografia como um agente sensibilizante para cobrir o papel em fototermografia,
- Na indústria têxtil para melhorar o rayon e estabilizar nylon,
- Na eliminação de roedores.
 O nitrato de chumbo tem sido usado para fabricar fogos de artifício ou material pirotécnico. Autor: Grátis Free. Fonte: Pixabay.
O nitrato de chumbo tem sido usado para fabricar fogos de artifício ou material pirotécnico. Autor: Grátis Free. Fonte: Pixabay. Riscos
Incêndio e Explosão
Embora não seja um composto de combustível, se exposto a fogo ou calor, ele pode explodir, gerando óxidos tóxicos de nitrogênio.
Sendo um agente fortemente oxidante, existe o perigo de que um incêndio seja gerado se entrar em contato com materiais orgânicos.
Para a saúde
Produz irritação ocular, trato respiratório e digestivo. É tóxico por inalação e ingestão. Os sintomas mais comuns de envenenamento por este composto são gastrointestinais, cólicos, constipação e fraqueza que podem se tornar paralisia de alguns músculos, entre outros, entre outros.
Sua ingestão também pode causar dor, cólicas, depressão, coma e morte.
Para o ambiente natural
É tóxico para os organismos aquáticos e terrestres, além disso, seus danos são persistentes e bioacumula nos seres vivos, portanto, é considerado um poluente perigoso e não deve ser descartado para o meio ambiente.
Se por acidente for derramado em água, deve ser neutralizado com óxido de cálcio (CAO), carbonato de cálcio (caco3) ou bicarbonato de sódio (Nahco3).
Foi confirmado que é carcinogênio para animais e possivelmente para o ser humano.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Chumbo (ii) nitrato. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Hsih, t.E. et al. (2015). Célula solar eficiente de póvskita fabricada usando um precursor aquoso de nitrato de chumbo. Chem Commun (mudança). 2015 4 de setembro; 51 (68): 13294-7. NCBI se recuperou.Nlm.NIH.Gov.
- Vratny, f. e Gugliotta, f. (1963). A decomposição tema de nitrato de chumbo. J. Inorg. Nucl. Chem., 1963, vol. 25, pp. 1129-1132. Recuperado de cientedirect.com.
- Chakraborty, J.N. (2014). Tingindo com cores minerais. Em fundos e práticas em coração de têxteis. Recuperado de cientedirect.com.
- Kumari, h. e Atwood, J. (2017). Calixarenos no estado sólido. Em referência modulada em química, ciências moleculares e engenharia química. Recuperado de cientedirect.com.
- Jeffery, p.G. e Hutchison, D. (1981). Alumínio. Em métodos químicos de análise rochosa (terceira edição). Recuperado de cientedirect.com
- Sandler, s.R. e Karo, W. (1992). Cianos, isocianatos, tiocianatos e isotiocianatos. No livro de origem de preparativos de laboratório orgânico avançado. Recuperado de cientedirect.com.
- Smith, p.C.G. et al. (1969). Compostos de halogênio aromáticos. Em química aromática. Recuperado de cientedirect.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- Fundação Wikimedia (2020). Chumbo (ii) nitrato. Recuperado de.Wikipedia.org.
- Shinde, d.V. et al. (2017). Efício e estabilidade aprimorada de uma célula solar aquosa à base de nitrato de chumbo-nitrato. ACS APPL. Mater. 2017 Interfaces, 9, 14023-14030. Recuperado de bares.ACS.org.
- « Fenóis ou compostos fenólicos propriedades, tipos, aplicações
- Estrutura de acetato de chumbo, propriedades, obtenção, usa »

