Nitrato de cobre (II)
- 2655
- 107
- Gilbert Franecki
 Fórmula e estrutura do nitrato de cobre (II)
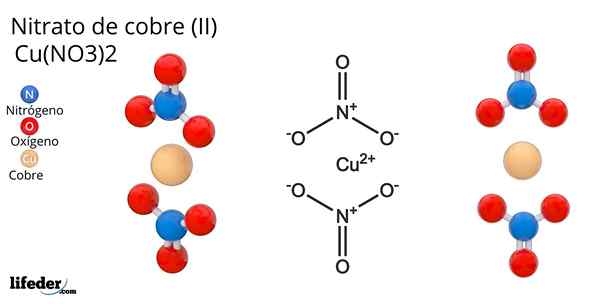
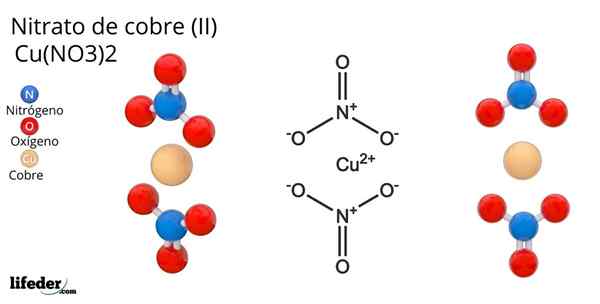
Fórmula e estrutura do nitrato de cobre (II) Ele Nitrato de cobre (Ii) ou nitrato cúprico, cuja fórmula química é Cu (não3)2, É um sal inorgânico brilhante e cores verde-azul atraentes. É sintetizado em escala industrial da decomposição de minerais de cobre, incluindo Gerhardita e Rouaita Minerals.
Outros métodos mais viáveis, em termos de matéria -prima e quantidades desejadas de sal, consistem em reações diretas com cobre de metal e seus compostos derivados. Quando o cobre está em contato com uma solução concentrada de ácido nítrico (HNO3), uma reação redox ocorre.
Nesta reação, o cobre oxida e o nitrogênio é reduzido de acordo com a seguinte equação química:
Cu (s) + 4hno3(conc) => cu (não3)2(AC) + 2h2Ou (l) + 2no2(g)
Dióxido de nitrogênio (não2) é um gás marrom e prejudicial; A solução aquosa resultante é azulada. O cobre pode formar o íon cuproso (Cu+), O íon cupric (Cu2+) ou o íon menos comum cu3+; No entanto, o íon cuproso não é favorecido na mídia aquosa por muitos fatores eletrônicos, de energia e geométrica.
O potencial de redução padrão para Cu+ (0,52V) é maior que para Cu2+ (0,34V), o que significa que o Cu+ É mais instável e tende a ganhar um elétron para se tornar Cu (s). Esta medida de eletroquímica explica por que não há Cuno3 como um produto da reação, ou pelo menos na água.
[TOC]
Propriedades do nitrato de cobre
 Aparência de nitrato de cobre (ii) Triohydrate
Aparência de nitrato de cobre (ii) Triohydrate O nitrato de cobre é anidrido (seco) ou hidratado com diferentes proporções de água. Anidrido é um líquido azul, mas depois de coordenar com moléculas de água - capaz de formar pontes de hidrogênio - cristaliza como Cu (não3)2· 3h2O o cu (não3)2· 6h2QUALQUER. Estas são as três formas de sal mais disponíveis no mercado.
Pode servir a você: Helmholtz Livre Energy: Units, como é calculado, exercícios resolvidosO peso molecular para sal seco é 187,6 g/mol, aumentando esse valor 18 g/mol para cada molécula de água incorporada ao sal. Sua densidade é igual a 3,05 g/ml e diminui em cada molécula de água embutida: 2,32 g/ml para sal hidratado de tri-hidratado e 2,07 g/ml para sal hidratado por hexa. Não tem ponto de ebulição, mas sublima.
As três formas de nitrato de cobre são altamente solúveis em água, amônia, dioxano e etanol. Seus pontos de fusão descendem à medida que outra molécula é adicionada à esfera de coordenação externa do cobre; A fusão é seguida pela decomposição térmica de nitrato de cobre, produzindo os gases nocivos de não2:
2 Cu (não3)2(s) => 2 CuO (s) + 4 não2(g)+ ou2(g)
A equação química acima é para sal anidrido; Para sais hidratados, o vapor de água também ocorrerá no lado direito da equação.
Configuração eletronica
Configuração eletrônica para ion cu2+ É [AR] 3D9, Apresentando paramagnetismo (o elétron no orbital 3D9 desapareceu).
Como cobre é um metal de transição do quarto período da tabela periódica, e tendo perdido dois de seus elétrons de Valência por ação do HNO3, Ele ainda tem orbitais 4s e 4p disponíveis para formar ligações covalentes. Ainda mais, o CU2+ Você pode usar dois de seus orbitais 4D mais externos para poder coordenar até seis moléculas.
Os ânions não3- Eles são planos e para o CU2+ Você pode coordenar com eles deve ter uma hibridação SP3d2 Isso permite que você adote uma geometria octaédrica; Isso impede os ânions de não3- ser "atingido" entre eles.
Pode servir a você: fórmula condensada: o que são e exemplos (metano, etano, glicose ...)Isso é conseguido por Cu2+, Colocando -os em um plano quadrado ao redor. A configuração resultante para o átomo de Cu no sal é: [AR] 3D94s24p6.
Estrutura química
 Estrutura de nitrato de cobre (ii)
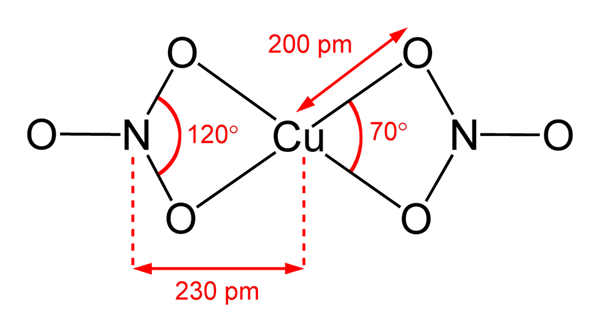
Estrutura de nitrato de cobre (ii) Na imagem superior, uma molécula isolada de Cu é representada (não3)2 em uma fase gasosa. Os átomos de oxigênio do ânion nitrato são diretamente coordenados com o centro de cobre (esfera de coordenação interna), formando quatro ligações Cu-O.
Tem uma geometria molecular do plano quadrado. O avião é desenhado pelas esferas vermelhas nos vértices e na esfera de cobre no centro. As interações fase gasosas são muito fracas devido a repulsões eletrostáticas entre grupos não3-.
No entanto, na fase sólida, os centros de cobre formam links de metal -Cu-Cu-, criando cadeias poliméricas de cobre.
Moléculas de água podem formar pontes de hidrogênio com grupos não3-, e estes oferecerão pontes de hidrogênio para outras moléculas de água, e assim por diante até uma esfera de água ao redor de Cu (não3)2.
Nesta esfera, pode ter 1 a 6 vizinhos externos; Portanto, o sal é facilmente hidratado para gerar sais hidratados de Tri e Hexa.
O sal é formado a partir de um ion cu2+ e dois íons não3-, concedendo uma cristalinidade característica de compostos iônicos (ortorrombic para sal anidrídeo, rhomboédica para sais hidratados). No entanto, os links são de maior caráter covalente.
Usa/aplicações
Para as cores fascinantes do nitrato de cobre, esse sal considera o uso como um aditivo em cerâmica, em superfícies metálicas, em alguns fogos de artifício e também na indústria têxtil como mordente.
Pode servir você: entalpiaÉ uma boa fonte de iônica para muitas reações, especialmente aquelas em que catalisa as reações orgânicas. Ele também encontra usos semelhantes a outros nitratos, como fungicida, herbicida ou como conservante de madeira.
Outro de seus principais e mais novos usos está na síntese de catalisadores de Cuo, ou materiais com qualidades fotossensíveis.
Também é usado como um reagente clássico nos laboratórios de ensino para mostrar reações dentro de células voltaicas.
Riscos
- É um agente fortemente oxidante, prejudicial ao ecossistema marinho, irritante, tóxico e corrosivo. É importante evitar todo contato físico diretamente com o reagente.
- Não é inflamável.
- Se decompõe a altas temperaturas liberando gases irritantes, entre estes2.
- No organismo humano, pode causar danos crônicos aos sistemas cardiovasculares e nervosos centrais.
- Pode causar irritações no trato gastrointestinal.
- Sendo um nitrato, dentro do corpo, torna -se nitrito. O nitrito aumenta a devastação nos níveis de oxigênio no sangue e no sistema cardiovascular.
Referências
- Dia, r., & Underwood, um. Química analítica quantitativa (Quinta ed.). Pearson Prentice Hall, P-810.
- Mel Science. (2015-2017). Mel Science. Recuperado da ciência MEL: Melscience.com
- ResearchGate GmbH. (2008-2018). Pesquisa. Recuperado do ResearchGate: ResearchGate.líquido
- Laboratório de ciências. Laboratório de ciências. Recuperado do Science Lab: Sciencelab.com
- Whitten, Davis, Peck e Stanley. (2008). Química (Oitava ed.). P-321. Cengage Learning.
- Wikipedia. Wikipedia. Wikipedia se recuperou: em.Wikipedia.org

