Estrutura química de nitrato de bário, usos, propriedades

- 721
- 182
- Dennis Heidenreich
Ele nitrato de bário É um sal composto por um átomo de bário (BA) e íon nitrato (não3). É apresentado como um sólido cristalino branco à temperatura ambiente e existe na natureza como um mineral muito raro conhecido como nitrobarita. Suas propriedades o tornam um composto tóxico que deve ser cuidadosamente gerenciado.
De fato, este composto tem vários usos na indústria militar, pois pode ser vinculado a outras substâncias químicas e adicionado a formulações explosivas e incendiárias, entre outros.
 Aparência de nitrato de bário. Fonte: w. OELEN/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Aparência de nitrato de bário. Fonte: w. OELEN/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) [TOC]
Fórmula
O nitrato de bário, também chamado de diitrato de bário, tem a fórmula química BA (não3)2, e geralmente é fabricado através de dois métodos.
O primeiro deles envolve a dissolução de pequenos pedaços de carbonato de bário (Baco3) Em um meio -médio -acídico (HNO3, um ácido mineral altamente corrosivo), permitindo que as impurezas de ferro precipitem e, em seguida, essa mistura é filtrada, evaporada e cristalizada.
O segundo método é feito através da combinação de cloreto de bário (BACL2, um dos sais de bário de maior solubilidade na água) com uma solução pré -aquecida de nitrato de sódio. Isso gera uma reação que resulta na separação de cristais de nitrato de bário da mistura.
Estrutura química do nitrato de bário
Este sal apresenta características da estrutura cristalina cúbica ou octanidros anidro.
Sua estrutura química é a seguinte:
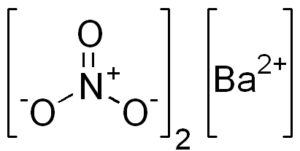
Dissociação
Em altas temperaturas (592 ºC), o nitrato de bário se decompõe para formar óxido de bário (BAO), dióxido de nitrogênio (NO2) e oxigênio (ou2), De acordo com a seguinte reação química:
Pode servir você: hidróxido de beryl (be (oh) 2)2ba (não3)2 + Calor → 2bao + 4no2 +QUALQUER2
Em meio com altas concentrações de óxido nítrico (NO), a decomposição do nitrato de bário produz um composto chamado nitrito de bário (BA (não2)2), De acordo com a seguinte equação:
Banheiro3)2 + 2no → ba (não2)2 + 22
Reações com metal solúvel ou sulfatos de ácido sulfúrico (H2SW4) gerar sulfato de bário (Baso4). A grande maioria dos sais de bário insolúvel, como carbonato (Baco3), Oxalato (BAC2QUALQUER4) ou fosfato de metal (BA3(PO4)2), são precipitados por reações de decomposição dupla semelhante.
Usos de nitrato de bário
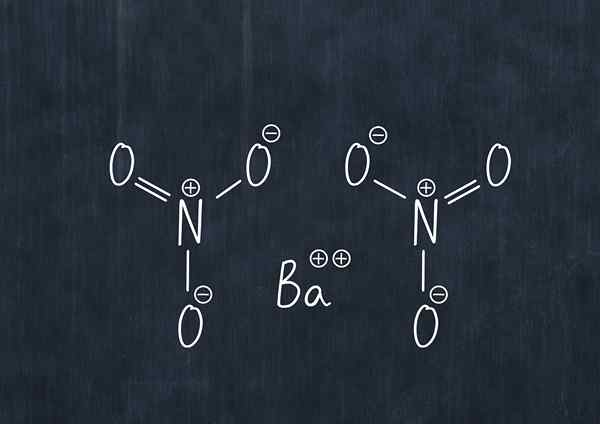 Fórmula química de nitrato de bário
Fórmula química de nitrato de bário Esta substância no pó é um agente oxidante e reage significativamente com agentes redutores comuns.
Quando esse sal é misturado com outros metais, como alumínio ou zinco em suas formas finamente divididas, ou com ligas como o alumínio-magn0esio, ele liga e explora o impacto. Por esse motivo, o nitrato de bário é considerado um excelente componente de armas e explosivos militares.
Juntamente com trinitrotolueno (comercialmente conhecido como TNT, ou C6H2(NÃO2)3CH3) e um fichário (cera regularmente parafina), esse sal forma um composto chamado Baratol, que possui propriedades explosivas. A alta densidade de nitrato de bário faz com que o baratol também adquira uma densidade maior, tornando -o mais eficaz em sua função.
O nitrato de bário também se junta à poeira de alumínio, uma fórmula que resulta na formação de pólvora piscando, que é usada principalmente em fogos de artifício e pirotecnia teatral.
Este flashes também viu usos na produção de explosões (como medidas antimis de aviões) e em granadas atordoadas. Além disso, esta substância é altamente explosiva.
Pode atendê -lo: cianeto de sódio (NACN): estrutura, propriedades, riscos, usosEste sal é combinado com a mistura reagente chamada Thermite para formar uma variação desse termo de captura tão compatível, que gera flashes curtos e muito poderosos de altas temperaturas em pequenas áreas por um curto período de tempo.
O Termate-Th3 é um termo que contém uma composição de 29 % pelo peso do nitrato de bário, que ajuda a aumentar o efeito térmico, gerar chamas e reduzir significativamente a temperatura de ignição do termo.
Os outros são geralmente usados na produção de granadas incendiárias e têm a função de destruir a armadura e as estruturas do tanque militares.
Além disso, o nitrato de bário foi um dos ingredientes mais utilizados na produção de acusações incendiárias usadas pelos britânicos em seus aviões de guerra durante a Segunda Guerra Mundial, que armados com munição incendiária que serviu para destruir planos inimigos.
Finalmente, esse sal tem usos no processo de fabricação de óxido de bário, na indústria de válvulas termiônicas e, como já disse, na criação de pirotecnia, especialmente as de cores verdes.
Propriedades físicas e químicas
 Bario Bai Nitrato (No3) 2
Bario Bai Nitrato (No3) 2 O sal é apresentado como um sólido branco, higroscópico e vaso sanitário, que é pouco solúvel em água e totalmente insolúvel em álcoois.
Tem uma massa molar de 261.337 g/mol, uma densidade de 3,24 g/cm3 e um ponto de fusão de 592 ºC. Ao atingir seu ponto de ebulição, ele quebra, como foi dito acima. À temperatura ambiente, possui solubilidade de água de 10,5 g/100 ml.
É considerado estável, mas é um forte agente oxidante e deve estar longe de materiais combustíveis para evitar fogo. Tem sensibilidade à água e não deve ser misturado com ácidos ou anidros.
Pode atendê -lo: isotermas de adsorção: conceito, tipos, exemplosEm altas concentrações (por exemplo, recipientes) devem ser isolados de substâncias que podem fazê -lo reagir, pois pode explorar violentamente.
Como qualquer outro composto solúvel do bário, é uma substância tóxica para animais e seres humanos.
Não deve ser inalado ou consumido, uma vez que os sintomas de envenenamento (especialmente o endurecimento dos músculos faciais), vômitos, diarréia, dor abdominal, tremores musculares, ansiedade, fraqueza, desconforto respiratório, irregularidade cardíaca e crises e crises e convulsões.
A morte pode ocorrer após um envenenamento com esta substância, algumas horas ou alguns dias após a apresentação.
A inalação de nitrato de bário gera irritação na mucosa respiratória e, em ambos os modos de envenenamento, soluções de sais de sulfato devem estar preparadas para aplicar os primeiros socorros aos afetados.
No caso de derramamentos, ele deve ser isolado de substâncias e materiais combustíveis e, em casos de incêndio, você nunca deve entrar em contato com produtos químicos ou espumas secas. A área deve ser inundada com água se o fogo for maior.
Referências
- Mabus. (s.F.). ScienceMadness. Obtido da ScienceMadness.org
- BOMBO INCENIÁRIA DE ESTADOS UNIDOS TH3-M50A3. (s.F.). Obtido de amunhas.com
- Cameo Chemicals. (s.F.). Obtido de aparições,.NOAA.Gov
- Chemspider. (s.F.). Obtido da Chemspider.com
- « Soj estágios e características de circuito produtivo
- Dinâmica de exemplos de sistema de partículas, exercícios »

