Modelos atômicos
- 4395
- 795
- Shawn Leffler
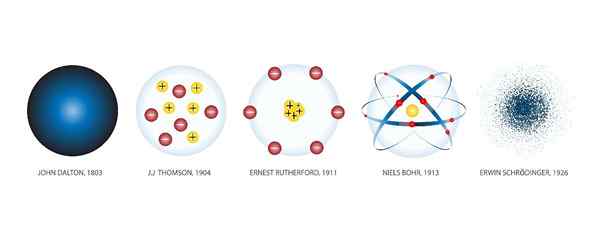
 Modelos atômicos são as diferentes representações gráficas que foram dadas aos átomos ao longo da história. Shuttersock
Modelos atômicos são as diferentes representações gráficas que foram dadas aos átomos ao longo da história. Shuttersock O que são modelos atômicos?
O Modelos atômicos São representações gráficas da estrutura e operação de um átomo. Houve inúmeros modelos ao longo da história.
Isso ocorre porque a idéia do átomo como um bloqueio fundamental do qual a matéria é feita, nasceu milhares de anos atrás, na Grécia antiga. Naquela época, o átomo era apenas um produto da especulação filosófica.
À medida que novas descobertas científicas foram feitas, novos modelos foram criados para incorporar o conhecimento adquirido. E assim aconteceu século depois do século até hoje, quando a tecnologia nos permitiu observar átomos através de microscópios e determinar o modelo correto.
O que são átomos?
Os átomos são estruturas submicroscópicas das quais todo o assunto que percebemos é formado e com o qual interagimos todos os dias, do nosso próprio corpo, da comida que comemos, das roupas que vestimos, dos grandes arranha -céus e da aeronaves.
Além disso, o sol, a lua, os planetas, as estrelas e as galáxias são formadas com átomos.
Estes são tão pequenos que não podem ser vistos com microscópios comuns. Outros são exigidos de maior poder, chamado ultramicroscópios. No entanto, os átomos não são as menores unidades da natureza.
Os átomos são formados por sua vez por partículas ainda menores: prótons, nêutrons e elétrons.
Os prótons têm carga elétrica positiva, enquanto os nêutrons não têm carga elétrica. Esses dois tipos de partículas formam o núcleo do átomo.
Girando em torno do núcleo como planetas ao redor do sol são elétrons, que têm uma carga elétrica negativa.
Modelo atômico de Democrito

Demócrito de Abdera era um filósofo grego que viveu entre 460 e 370 antes da era atual. Ele afirmou que toda a matéria era formada por pequenas partículas que ele chamava de átomos, o que em grego significa indivisível.
Segundo Demócrito, o átomo é a menor porção em que o assunto pode ser dividido. Há um número infinito deles, que são indestrutíveis, incríveis, eternos e absolutamente compactos, sem poros. Existem vários tipos, que diferem por forma, magnitude, posição e a maneira como estão dispostos.
Pode atendê -lo: desastres causados pelo ser humano ao usar a ciência e a tecnologiaA teoria do Demócrito foi rejeitada por Aristóteles e depois totalmente esquecida até o surgimento da ciência moderna.
Modelo atômico de Dalton

John Dalton (1766-1844) era um meteorologista inglês interessado em investigar as leis que governam o comportamento do gás. Fruto de seu trabalho nesse campo foi o primeiro modelo atômico da ciência moderna, que ele fez em 1803.
Como a existência de prótons e elétrons ainda não havia sido descoberta, Dalton disse, como o Demócrito, que o átomo é a menor porção em que a matéria pode ser dividida e, portanto, por si só, é indivisível.
Segundo Dalton, os átomos são sólidos e têm uma forma esférica, como uma bola de beisebol. Dalton ilustrou sua teoria escultura em madeira, junto com seus assistentes, dezenas de esferas que representavam átomos de diferentes elementos químicos.
Este modelo estava em vigor até a descoberta do elétron.
Modelo Atômico de Thomson
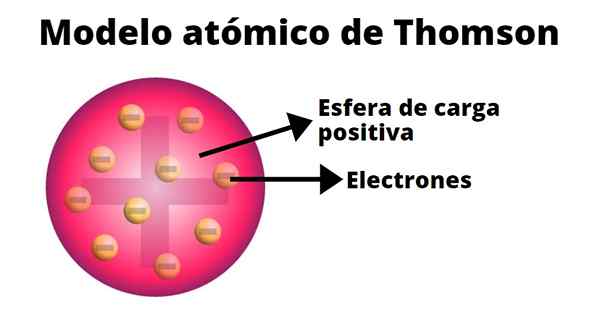
O físico inglês Joseph John Thomson (1865-1940) teve que fazer uma das descobertas mais importantes da ciência moderna: a do elétron.
Foi em 1897, no Laboratório Cavendish da Universidade de Cambridge, na Inglaterra, onde uma placa ainda comemora a grande descoberta.
Thompson e seus assistentes projetam um catódico em um campo elétrico. Após o contato com o campo, os raios se desviaram da formação de ângulos amplos. Isso confirmou que os raios do cátodo tinham uma carga elétrica negativa. Aquelas partículas carregadas negativamente os chamavam de elétrons.
Thomson assumiu que os elétrons estavam incorporados em átomos. Seu modelo atômico data de 1904.
O pudim de passas
No modelo atômico de Thompson, o átomo é uma esfera sólida com uma carga positiva (prótons) sobre a qual os nêutrons (carga negativa) são distribuídos aleatoriamente, como passas jogadas no pudin. É por isso que esse modelo era conhecido como "Pudin de Pasas".
Segundo Thompson, o átomo tem um raio de 0,00000001 centímetros e sua carga é neutra, pois prótons e elétrons têm a mesma carga, mas de sinal oposto.
O modelo Thompson não apresenta nêutrons.
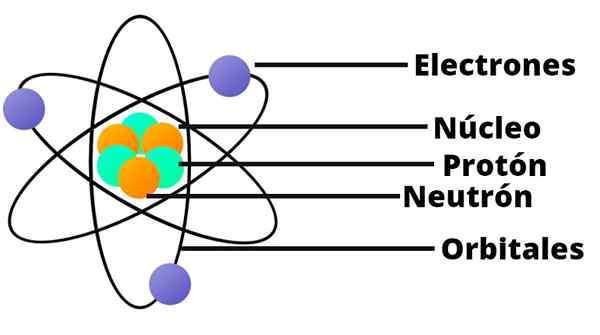
Modelo Atômico de Rutherford
Ernest Rutherford (1871-1937), um físico neoziliano, foi um dos estudantes mais proeminentes de Thomson.
Pode atendê -lo: pesquisa correlacionalEm 1911, e com base na descoberta recente da radioatividade, Rutherford realizou o seguinte experimento: eles dispararam partículas radioativas alfa de alta velocidade e energia contra uma folha de ouro.
Se o modelo atômico de Thompson estivesse correto, as partículas alfa passariam pela folha sem se desviar ou com um desvio insignificante. No entanto, quando eles calcularam o ângulo de desvio das partículas, descobriram que era largo e que alguns até pulando contra a folha de ouro.
Com este resultado, Rutherford entendeu que o átomo deveria ter um núcleo muito pequeno e altamente condensado. Este núcleo foi carregado positivamente.
Um pequeno sistema solar
O modelo atômico de Rutherford é como um sistema solar em miniatura. No centro, no local que corresponderia ao sol, existe o núcleo com seus prótons carregados positivamente. Em torno disso, orbitando como planetas, existem elétrons distribuídos aleatoriamente.
Rutherford também estabeleceu que a massa do átomo é equivalente à soma das massas de elétrons e prótons.
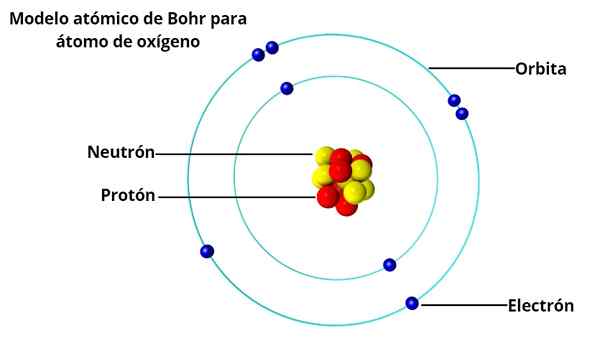
Modelo atômico Bohr
Embora o modelo Rutherford tenha sido um avanço inegável em relação aos modelos anteriores, ele tinha defeitos importantes. Por exemplo, se os elétrons efetivamente orbital ao redor do núcleo, acabariam perdendo energia e colapsariam no núcleo. Mas isso obviamente não aconteceu.
Era o físico dinamarquês Niels Bohr (1885-1962), um estudante de Rutherford da Universidade de Manchester (Inglaterra), que proporia em 1913 um modelo atômico que resolveu os problemas colocados por seu antigo professor.
Órbitas circulares
No modelo atômico de Bohr, os elétrons não orbitam livremente ao redor do núcleo, mas o fazem em órbitas circulares estáveis, separadas uma da outra por uma certa distância, semelhante a como os planetas do sistema solar são dispostos. Cada órbita é chamada de energia ou nível de energia.
Com base nas investigações de Max Planck e Albert Einstein, ele determinou que cada elétron em sua órbita tem uma certa quantidade de energia.
Enquanto orbita estável em torno do núcleo, diz -se que os elétrons estão em estado estacionário. Por outro lado, quando um elétron "salta" para uma órbita de energia mais baixa, há um fóton.
Pode atendê -lo: metodologiaNo entanto, o modelo Bohr não teve sucesso em explicar a operação de átomos com mais de um elétron.
Modelo Atômico Sommerfeld
Arnold Sommerfeld (1868-1951) era um físico alemão que dedicou seu trabalho à expansão do modelo atômico de Bohr. Este modelo estendido foi apresentado em 1916.
Baseado na teoria da relatividade de Einstein, Sommerfeld descobriu que alguns elétrons orbitam em torno do núcleo a velocidades próximas à luz (300.000 quilômetros por segundo).
Ele também fez as seguintes modificações no modelo Bohr:
- Os elétrons se movem ao redor do núcleo em órbitas circulares e elípticas. Bohr só reconheceu órbitas circulares.
- Dentro do mesmo nível de energia, existem sub -níveis com energias ligeiramente diferentes.
Modelo mecânico quântico (Broglie, Heisenberg e Schrödinger)
Este é o modelo atômico mais preciso conhecido e atualmente aceito, com algumas adições subsequentes. Foi desenvolvido por três cientistas: o alemão Werner Heisenberg (1901-1976), o austríaco Erwin Schrödinger (1887-1961) e o francês Louis de Broglie (1892-1987).
Este modelo descarta a idéia de elétrons que orbitam o núcleo. Em vez disso, temos nuvens eletrônicas, que são espaços ao redor do núcleo em que é possível encontrar um elétron. Isso se comporta como uma onda estacionária.
A probabilidade de encontrar é calculada com uma equação estabelecida por Schrödinger.
Este é o modelo mecânico quântico do átomo que começou a partir da equação de Schrödinger. Com esta equação, você pode saber a probabilidade de encontrar um elétron em um certo ponto de um átomo.
Neste modelo, cada elétron se move em uma direção específica, que é determinada por quatro números quânticos, que são: número quântico principal, número quântico secundário, número quântico magnético e rotação do número quântico.
Não existem dois elétrons que possuam números quânticos idênticos, como afirmado pelo princípio de exclusão descoberto pelo físico Wolfgang Pauli.
Referências
- (2010). Átomo. Enciclopédia moderna britânica.
- (s. F.). Modelo atômico do Demócrito, Atomismo Filosófico. Retirado de energia nuclear.líquido.
- (s. F.). Modelo Atômico Sommerfeld, Expansão para o Modelo Bohr. Retirado de energia nuclear.líquido.
- Bertsch, g. F.; Trefil, James e McGrayne, Sharon Bertsch (2021). Átomo. Enciclopédia Britannica. Tirado de Britannica.com.
- Duignan, b. (2021). Demócrito. Enciclopédia Britannica. Tirado de Britannica.com.
- Novo World Encyclopedia Colaboradores. (2021). Átomo. Retirado da NewWorldyClopedia.org.
- Zita, Ana. (s. F.). Modelos atômicos. Retirado de Todamateria.com.

