Ácido clorídrico (HCl)

- 2293
- 143
- Pete Wuckert
 Recipiente com ácido clorídrico. Shuttersock
Recipiente com ácido clorídrico. Shuttersock O que é ácido clorídrico?
Ele ácido clorídrico (HCl), ou ácido muriático, é um composto inorgânico formado pela solução em água de cloreto de hidrogênio, causando o íon hidrônio (H3QUALQUER+) e o íon cloreto (CL-). Mais especificamente, é a hidratia do halogênio de cloro com hidrogênio.
HCl é um ácido forte que é completamente ionizado na água e seus produtos de ionização são estáveis. A ionização completa de HCl é corroborada pelo fato de que o pH de uma solução de HCl 0,1 M é 1.
O principal método para a produção industrial de HCL é a cloração de compostos orgânicos para produzir, por exemplo, diclorometano, tricloretileno, percloroetileno ou cloreto de vinil. HCl é um subproduto da reação de cloração.
É usado em graus de base em inúmeras reações químicas, na digestão química de compostos orgânicos, etc.
Vapores de ácido clorídrico (cloreto de hidrogênio) podem causar lesões oculares graves. Eles também podem produzir irritação e problemas graves nas vias aéreas.
A luz gástrica tem um pH ácido (1-3) com uma alta concentração de HCl. A presença ácida favorece a esterilização do conteúdo gástrico, inativando numerosas bactérias presentes em alimentos. Isso explicaria a gastroenterite associada à condição de acroeridia.
Além disso, o HCL facilita a digestão das proteínas ativando a enzima pepsina da ação proteolítica.
É usado na limpeza das piscinas, um detergente comum geralmente é suficiente, mas há pontos que aderem entre os ladrilhos, exigindo nesses casos o uso de ácido clorídrico.
É usado no controle de pH em produtos farmacêuticos, alimentos e água potável. Também é usado na neutralização de fluxos de resíduos contendo material alcalino.
O ácido clorídrico é usado na regeneração de trocas de íons, usadas para sequestrar íons metálicos ou outros tipos de íons na indústria, em laboratórios de pesquisa e purificação da água potável.
Por outro lado, também pode ser comentado que o cloreto de hidrogênio, o composto gasoso, é uma molécula diatômica e os átomos que o formam são unidos por uma ligação covalente. Enquanto isso, o ácido cloohídrico é um composto iônico que em solução aquosa é dissociada em h+ e cl-. A interação entre esses íons é eletrostática.
Estrutura química do ácido clorídrico
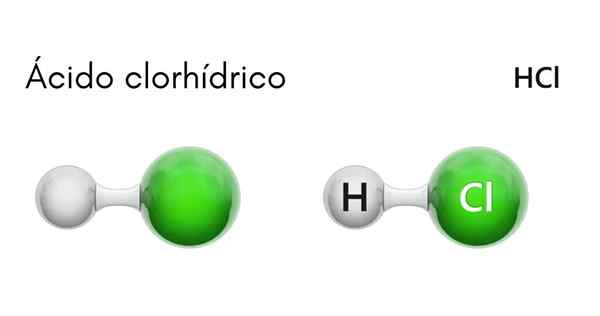
Cada molécula de HCl é formada por um átomo de hidrogênio e outro de cloro. Embora à temperatura ambiente, o HCl seja venenoso e um gás incolor, se dissolvido em água, ocorre o ácido clorídrico.
Formação do ácido clorídrico
-Pode ser produzido por eletrólise NACL (cloreto de sódio) que causa h2 (G), Cl2 (g), 2º (AC) e OH- (AC). Então:
H2 + Cl2 => 2 HCl
Esta é uma reação exotérmica.
-HCl ocorre reagindo cloreto de sódio com ácido sulfúrico. Processo que pode ser esquematizado da seguinte forma:
NaCl +h2SW4 => Nahso4 + Hcl
Pode atendê -lo: sais ácidos (oxisals)Em seguida, o cloreto de hidrogênio é coletado e o cloreto de sódio com bissulfito de sódio de acordo com a seguinte reação é reagido:
NACL +NAHSO4 => Na2SW4 + Hcl
Esta reação foi introduzida por Johan Glauber no século XVII para produzir ácido clorídrico. Atualmente é usado em laboratórios, uma vez que a importância de seu uso industrial diminuiu.
-O ácido clorídrico pode ser produzido como um subproduto da cloração de compostos orgânicos, como: na produção de diclorometano.
C2H4 + Cl2 => C2H4Cl2
C2H4Cl2 => C2H3Cl +hcl
Este método de produção de HCl é usado mais industrialmente, calculando que 90% do HCL produzido nos Estados Unidos é por essa metodologia.
-E, finalmente, o HCL ocorre na incineração de resíduos orgânicos clorados:
C4H6Cl2 + 5 o2 => 4 CO2 + 2 h2O +2 hcl
Onde está o ácido clorídrico?
O ácido clorídrico está concentrado na luz gástrica, onde um pH de 1 é alcançado. A existência de uma barreira de muco, rica em bicarbonato, impede que as células gástricas sofram danos devido ao baixo pH gástrico.
Existem três estímulos fisiológicos principais para a secreção de H+ pelas células parietais do corpo gástrico: gastrina, histamina e acetilcolina.
Gastrina
A gastrina é um hormônio secretado na região do clube gástrico que age aumentando a concentração intracelular de CA, um intermediário da ativação do transporte ativo de H+ em direção à luz gástrica.
O transporte ativo é feito por uma enzima ATPAY que usa a energia contida no ATP para transportar H+ em direção à luz gástrica e introduzir k+.
Histamina
É secretado pelas células chamadas de som semelhantes às enterocromofinas (SEC) do corpo gástrico. Sua ação é mediada por um aumento na concentração de amplificador cíclico e age aumentando, bem como a gastrina, transporte ativo de h+ Em direção à luz gástrica mediada por uma bomba H+-K+.
Acetilcolina
É secretado pelos terminais do nervo vagal, bem como pela gastrina média, sua ação para um aumento na CA intracelular, ativando a ação da bomba H+-K+.
O h+ de células parietais vem da reação do CO2 com h2Ou para formar H2Co3 (ácido carbónico). Isso é posteriormente dividido em H+ e HCO3-. O h+ É transportado ativamente para a luz gástrica através da membrana apical gástrica. Enquanto isso, o HCO3- É levado para o sangue acoplado à entrada de CL-.
O mecanismo de golpe de contratransporte ou antitransport-HCO3- que ocorre na membrana basal das células parietais produz o acúmulo intracelular de CL-. Posteriormente, o íon vai para a luz gástrica que acompanha H+. Estima -se que a secreção gástrica da HCL tenha uma concentração de 0,15 m.
Outras fontes biológicas de HCL
Existem outros estímulos para a secreção de HCl por células parietais, como cafeína e álcool.
A úlcera gástrica e duodenal ocorre quando a barreira é interrompida que protege as células gástricas da ação prejudicial da HCL.
Pode atendê -lo: sulfeto de zinco (ZnS)Eliminando a ação protetora mencionada acima, bactérias Helicobacter Pilori, Ácido acetilsalicílico e anti -inflamatórios não -esteróides (AINEs) contribuem para a produção de úlcera.
A secreção ácida tem, em função. As principais células do segredo do corpo gástrico.
Propriedades físicas e químicas do ácido clorídrico
Peso molecular
36.458 g/mol.
Cor
É um líquido incolor ou um pouco amarelado.
Cheiro
É um cheiro irritante de hectare.
Sabor
O limiar para provar em água pura é uma concentração de 1,3 x 10-4 Moles/L.
Ponto de ebulição
-121º F a 760 mmHg. -85,05º C a 760 mmHg.
Ponto de fusão
-174º F (-13,7 º F) para uma solução HCl de 39,7% p/p em água), -114,22º C.
Solubilidade em água
A solução HCl pode ter 67% P/P A 86º F; 82,3 g/100 g de água a 0ºC; 67,3 g/100 g de água a 30º C e 63,3 g/100 g de água a 40º C.
Solubilidade de metanol
51,3 g/100 g de solução a 0º C e 47 g/100 de solução a 20º C
Solubilidade de etanol
41,0 /100 g de solução a 20º C
Solubilidade de éter
24,9 G/100 Solução a 20º C.
Densidade
1.059 g/ml a 59º F em uma solução de 10,17 % P/P.
Densidade de gás
1.00045 g/l
Densidade de vapor
1.268 (no relacionamento aéreo tomado como 1)
Pressão de vapor
32.452 mmHg a 70ª f; 760 mmHg em -120,6 º f
Estabilidade
Tem alta estabilidade térmica.
Auto-direção
Não é inflamável.
Decomposição
Se decompõe por aquecimento emitindo uma fumaça tóxica de cloro.
Viscosidade: 0,405 cPoise (líquido a 118,6 º K), 0,0131 cPoise (vapor a 273,06 º K).
Corrosividade
É altamente corrosivo de alumínio, cobre e aço inoxidável. Ele ataca todos os metais (mercúrio, ouro, platina, prata, tantalio, exceto por certas ligas).
Tensão superficial
23 mn/cm a 118,6º K.
Polimerização
Aldeídos e epóxidos experimentam uma polimerização violenta na presença de ácido clorídrico.
Propriedades físicas, como viscosidade, pressão do vapor, ponto de ebulição e ponto de fusão são influenciados pela concentração percentual para HCl.
Usos do ácido clorídrico
O ácido clorídrico tem numerosos usos em casa, em várias indústrias, em laboratórios de ensino e pesquisa, etc.
Industrial e em casa
-O ácido clorídrico é usado no processamento hidrometalúrgico, por exemplo, na produção de alumina e dióxido de titânio. É usado na ativação da produção de poços de petróleo.
A injeção de ácido aumenta a porosidade em torno do petróleo, favorecendo sua extração.
-É usado para a eliminação de depósitos de caco3 (Carbonato de cálcio) por transformação em cocl2 (cloreto de cálcio), que é mais solúvel e fácil de eliminar. Da mesma forma, é usado industrialmente no processamento de aço, material com numerosos usos e aplicações, tanto em indústrias quanto em construções e domicílios.
-Massas usam soluções HCL para lavar e limpar tijolos. É usado em casa no trabalho de limpeza e desinfecção dos banheiros e seus drenos. Além disso, o ácido clorídrico é usado em gravuras, incluindo operações de limpeza de metal.
Pode servir a você: térmico: estrutura, características, formação, exemplos-O ácido clorídrico é aplicado na eliminação do óxido de ferro mohoso.
Fé2QUALQUER3 + Fe +6 HCl => 3 FECL2 + H2QUALQUER
-Apesar de ser altamente corrosivo, é usado para remover manchas de metal presentes em ferro, cobre e latão, usando uma diluição de 1:10 na água.
Síntese e reações químicas
-O ácido clorídrico é usado em titulação base ou reações de alcalina, bem como na solução da solução pH. Além disso, é usado em inúmeras reações químicas, por exemplo, na digestão de proteínas, um procedimento antes dos estudos de conteúdo de aminoácidos e identificação.
-Um uso principal do ácido clorídrico é a produção de compostos orgânicos, como cloreto de vinil e diclorometano. O ácido é um intermediário na produção de policarbonatos, carbono ativado e ácido ascórbico.
-É usado em fabricantes de pegas. Enquanto na indústria têxtil, é usado no branqueamento de tecidos. É usado na indústria de bronzeamento de couro que intervenha em seu processamento. Ele também encontra uso como fertilizante e na produção de cloreto, corantes, etc. Também é usado na galvanoplastia, na fotografia e na indústria de borracha.
-É usado na produção de seda artificial, no refinamento de óleos, gorduras e sabonetes. Além disso, é usado em reações de polimerização, isomerização e alquilação.
Riscos e toxicidade do ácido clorídrico
Tem ação corrosiva na pele e nas membranas mucosas produzindo queimaduras. Estes, se graves, podem produzir ulcerações deixando cicatrizes de kelóides e retráteis. O contato visual pode causar redução total ou perda de visão devido a danos à córnea.
Quando o ácido atingir a face pode causar cicatrizes sérias que desfiguram o rosto. O contato frequente com o ácido também pode causar dermatite.
A ingestão de ácido clorídrico causa queimadura da boca, garganta, esôfago e trato gastrointestinal, causando náusea, vômito e diarréia. Em casos extremos, a perfuração do esôfago e do intestino pode ocorrer, com parada cardíaca e morte.
Por outro lado, vapores ácidos, dependendo de sua concentração, podem causar uma irritação do trato respiratório, causando faringite, edema da glote, estreitamento de brônquios com bronquite, cianose e edema pulmonar (acumulação excessiva de líquido nos pulmões) e em extremo casos, morte.
A exposição a altos níveis de vapores de ácido clorídrico pode causar inchaço e espasmo na garganta com a conseqüente asfixia.
A necrose dentária que se manifesta nos dentes também é frequente com a perda de seu brilho; Eles ficam amarelados e macios e finalmente quebram.
Referências
- Studiousguy. (2018). Ácido clorídrico (HCL): usos e aplicações importantes. Retirado de: StudiousGuy.com
- Ganong, w. F. (2003). Revisão da fisiologia médica. Vigésima primeira edição. A McGraw-Hill Companies Inc.
- Ctr. Folha de segurança de ácido clorídrico. [PDF]. Retirado de: UACJ.mx

