Modelo mecânico quântico do átomo

- 1899
- 248
- Orlando MacGyver
Qual é o modelo mecânico quântico do átomo?
Ele Modelo mecânico quântico do átomo Ele supõe que isso é formado por um núcleo central formado por prótons e nêutrons. Os elétrons, de carga negativa, envolvem o núcleo em regiões difusas conhecidas como orbitais.
A forma e a extensão dos orbitais eletrônicos são determinados por várias magnitudes: o potencial central e os níveis quantizados de energia e momento angular de elétrons.
 figura 1. Modelo de um átomo de hélio de acordo com a mecânica quântica. Consiste na nuvem de probabilidade dos dois elétrons de hélio que cercam um núcleo positivo 100 mil vezes menor. Fonte: Wikimedia Commons.
figura 1. Modelo de um átomo de hélio de acordo com a mecânica quântica. Consiste na nuvem de probabilidade dos dois elétrons de hélio que cercam um núcleo positivo 100 mil vezes menor. Fonte: Wikimedia Commons. De acordo com a mecânica quântica, os elétrons têm comportamento de partículas de onda dupla e a escala atômica é difusa e não específica. As dimensões do átomo são praticamente determinadas pela extensão dos orbitais eletrônicos em torno do núcleo positivo.
A Figura 1 mostra a estrutura do átomo de hélio, que tem um núcleo com dois prótons e dois nêutrons. Este núcleo é cercado pela nuvem de probabilidade dos dois elétrons que circundam o núcleo, que é cem mil vezes menor. Na imagem a seguir, você pode ver o átomo de hélio, com os prótons e nêutrons no núcleo e elétrons em orbitais.

O tamanho de um átomo de hélio é da ordem de um Angstrom (1 Å), ou seja, 1 x 10^-10 m. Enquanto o tamanho de seu núcleo é da ordem de um Femtômetro (1 fm), ou seja, 1 x 10^-15 m.
Apesar de ser tão pequeno comparativamente, 99,9% do peso atômico está concentrado no pequeno núcleo. Isso ocorre porque os prótons e nêutrons são 2.000 vezes mais pesados que os elétrons que os cercam.
Pode atendê -lo: os 31 tipos de força na física e suas característicasEscala atômica e comportamento quântico
Um dos conceitos que tiveram mais influência no desenvolvimento do modelo atômico foi o da dualidade Onda - partícula: A descoberta de que cada objeto material tem uma onda de matéria associada.
A fórmula que permite que o comprimento de onda seja calculado λ Associado a um objeto material foi proposto por Louis de Broglie em 1924 e é o seguinte:
λ = h / (m v)
Onde h É constante de Planck, m a massa e v a velocidade.
De acordo com o princípio de De Broglie, todo objeto tem um comportamento duplo, mas dependendo da escala de interações, velocidade e massa, o comportamento das ondas pode ser mais proeminente que a partícula ou vice -versa.
O elétron é leve, sua massa é 9,1 × 10^-31 kg. A velocidade típica de um elétron é de 6000 km/s (cinquenta vezes menor que a velocidade da luz). Esta velocidade corresponde aos valores de energia na faixa de dezenas de elétron-voltio.
Com os dados anteriores e, usando a fórmula de Broglie, o comprimento de onda para o elétron pode ser obtido:
λ = 6,6 x 10^-34 j s / (9,1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
O elétron para as energias típicas dos níveis atômicos tem um comprimento de onda da mesma ordem de magnitude que a da escala atômica, de modo que nessa escala ela tem comportamento ondulatório e não de partículas.
Primeiro modelos quânticos
Com a idéia em mente de que o elétron de escala atômica tem um comportamento ondulado, os primeiros modelos atômicos baseados em princípios quânticos foram desenvolvidos. Entre eles, o modelo atômico de Bohr se destaca, o que previu perfeitamente o espectro de emissão de hidrogênio, mas não o de outros átomos.
Pode atendê -lo: esforço de tensão: fórmula e equações, cálculo, exercíciosO modelo de Bohr e, posteriormente, o de Sommerfeld, eram modelos semi-clássicos. Ou seja, o elétron era como uma partícula sujeita à força de atração eletrostática do núcleo que orbita ao seu redor, governada pela segunda lei de Newton.
Além das órbitas clássicas, esses primeiros modelos levaram em consideração que o elétron tinha uma onda de material associada. Somente as órbitas cujo perímetro era um número inteiro de comprimentos de onda, pois aqueles que não atendem a esse critério desbotados por interferência destrutiva.
É então que a quantização da energia na estrutura atômica aparece pela primeira vez.
Palavra Quantum Precisamente vem do fato de que o elétron só pode levar alguns valores de energia discretos dentro do átomo. Isso coincide com a descoberta de Planck, que consistia na descoberta de que uma radiação de frequência F Interagir com a matéria em pacotes de energia E = h f, onde h É constante de Planck.
Forma e tamanho orbital
O escopo radial do orbital é determinado pelo Função de onda de radipara o. É maior na medida em que a energia do elétron cresce, ou seja, na medida em que o principal número quântico aumenta.
A distância radial é geralmente medida nos rádios bohr, que para a menor energia de hidrogênio é 5,3 x 10-11 m = 0,53 Å.
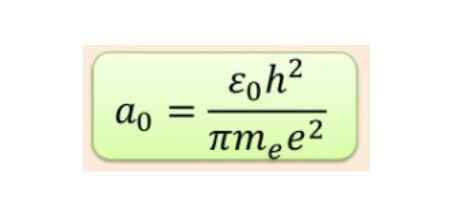 Figura 2. Fórmula do raio bohr. Fonte: f. Zapata.
Figura 2. Fórmula do raio bohr. Fonte: f. Zapata. Mas a forma dos orbitais é determinada pelo valor do número quântico de momento angular. Se l = 0 você tem um orbital esférico chamado s, se l = 1 você tem um orbital lobado chamado p, que podem ter três orientações de acordo com o número quântico magnético. A figura a seguir mostra a forma dos orbitais.
Pode atendê -lo: magnitude do vetor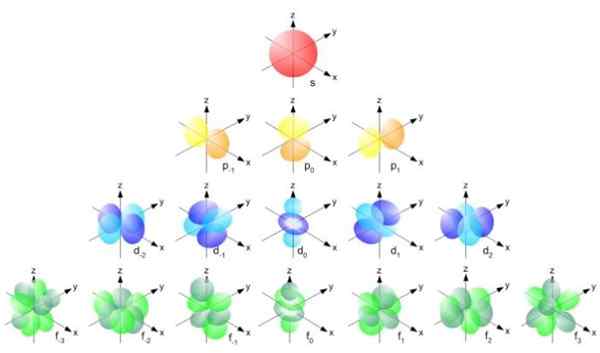 Figura 3. Forma dos orbitais S, P, D, F. Fonte: Ucdavis Chemwiki.
Figura 3. Forma dos orbitais S, P, D, F. Fonte: Ucdavis Chemwiki. Esses orbitais são embalados dentro de outros de acordo com a energia dos elétrons. Por exemplo, a figura a seguir mostra os orbitais em um átomo de sódio.
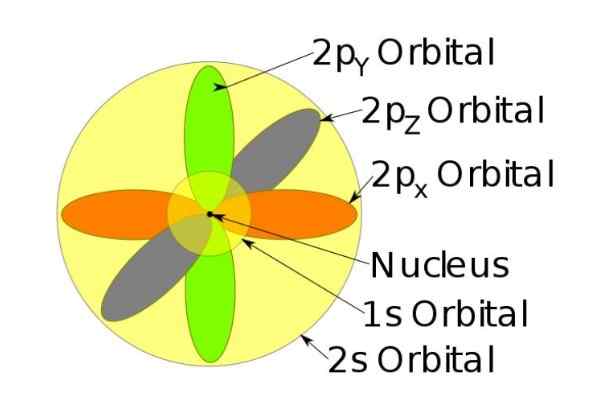 Figura 4. Orbitais 1s, 2s, 2p do íon de sódio quando perdeu um elétron. Fonte: Wikimedia Commons.
Figura 4. Orbitais 1s, 2s, 2p do íon de sódio quando perdeu um elétron. Fonte: Wikimedia Commons. A rotação
O modelo mecânico quântico da equação de Schrödinger não incorpora o giro de elétrons. Mas Pauli é levado em consideração através do princípio de exclusão, que indica que os orbitais podem preencher até dois elétrons com números de rotação quântica s = +½ e s = -½.
Por exemplo, o íon de sódio possui 10 elétrons, ou seja, se nos referirmos à figura anterior, existem dois elétrons para cada Orbital.
Mas se for o átomo de sódio neutro, existem 11 elétrons, o último dos quais ocuparia um orbital 3s (não mostrado na figura e de um raio maior que os 2s). O giro do átomo é decisivo nas características magnéticas de uma substância.
Referências
- Alonso - Finn. Fundações quânticas e estatísticas. Addison Wesley.
- Eisberg - Resnick. Física quântica. Limusa - Wiley.
- Gasiorowicz. Física quântica. John Wiley & Sons.
- Hsc. Curso de Física 2. Jacaranda Plus.
- Wikipedia. Modelo Atômico de Schrodinger. Recuperado de: Wikipedia.com

