Modelo atômico atual

- 716
- 54
- Lonnie MacGyver
Qual é o modelo atômico atual?
Ele Modelo atômico atual É o baseado na mecânica quântica, particularmente na equação de Schrödinger, no princípio de exclusão de Pauli e uma propriedade do elétron chamado rodar qualquer Espin.
É o modelo de maior aceitação e uso no estudo da estrutura de átomos, moléculas e na reatividade química dos elementos, devido à precisão de suas previsões e sua relativa simplicidade.
 figura 1. Átomo de hidrogênio em estado excitado e seus números atômicos: energia n = 4, momento angular l = 3 e momento magnético m = 1. Fonte: Wikimedia Commons.
figura 1. Átomo de hidrogênio em estado excitado e seus números atômicos: energia n = 4, momento angular l = 3 e momento magnético m = 1. Fonte: Wikimedia Commons. Este modelo é a evolução de vários modelos atômicos anteriores, como o modelo Rutherford e o de Bohr - Sommerfeld, considerado clássico ou semi -clássico modelos.
Atualmente, existem modelos teoricamente mais completos do que o modelo típico de Schrödinger, como o modelo Dirac-Jordan, que incorpora a relatividade especial e é baseada na equação do Dirac Wave. Nesta equação, a rotação, a propriedade dos elétrons mencionados no início, parece naturalmente.
Também existem modelos baseados na teoria do campo quântico, aplicado em física de alta energia. Esses modelos são excelentes na previsão da criação e aniquilação de partículas fundamentais, o objetivo desse campo da física.
Vale ressaltar que as teorias mais sofisticadas convergem para os mesmos resultados que os da equação de Schrödinger, especialmente para átomos de luz.
Características do modelo atômico atuais
Na visão do átomo atual, com base no quântico não relativista, não há conceito de órbita eletrônica no estilo de sistemas planetários.
No entanto, a imagem mais difundida do átomo ainda é a de um núcleo central positivo e alguns pontos de carga elétrica negativos (elétrons), transformando órbitas perfeitamente definidas ao redor do núcleo central. Mas, apesar de suas raízes, não corresponde mais ao modelo atômico atual.
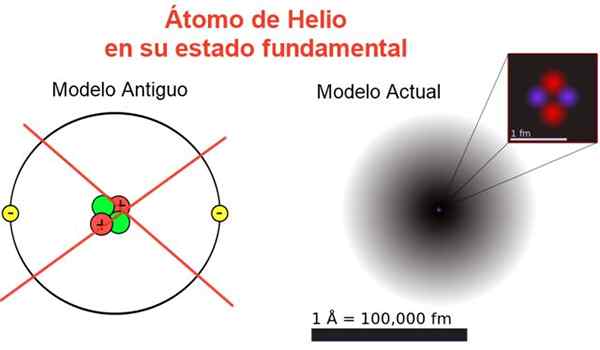 Figura 2. Imagem clássica e atual do átomo de hélio em seu estado fundamental. No modelo atual, os dois elétrons do átomo de hélio estão espalhados em uma região chamada orbital. Fonte: Wikimedia Commons, sua própria composição.
Figura 2. Imagem clássica e atual do átomo de hélio em seu estado fundamental. No modelo atual, os dois elétrons do átomo de hélio estão espalhados em uma região chamada orbital. Fonte: Wikimedia Commons, sua própria composição. A Figura 2 mostra a imagem antiga e a imagem atual de um átomo de hélio em seu estado de energia menor (nível n = 1 e l = 0).
Pode atendê -lo: aceleração média: como é calculado e resolvidoA imagem clássica é útil para ver que o núcleo contém dois prótons e dois nêutrons. Garantindo a neutralidade do átomo, existem dois elétrons ocupando o mesmo nível de energia.
Do resto, é uma imagem longe da realidade, uma vez que a escala do núcleo nem corresponde à do átomo: o núcleo é 1/100000 vezes o tamanho do átomo, mas é aí que a massa atômica está concentrada.
Dualidade onda - partícula
A mecânica clássica estabelece que toda partícula material tem uma onda associada, chamada Função de onda. Este é o famoso Dualidade da Partícula Onda De Louis de Broglie.
No modelo atômico atual, o comportamento do elétron na escala dos átomos é ondulante de destaque, enquanto no nível macroscópico, como os elétrons que se movem nos tubos de raios catódicos das televisões antigas, o comportamento corpuscular predomina.
Por outro lado, com fótons, isso acontece pelo contrário, na maioria dos fenômenos ópticos (no nível macroscópico), eles têm um comportamento fundamentalmente ondulatório. E quando eles interagem com assuntos de matéria, eles têm um comportamento de partícula.
Por causa disso, os elétrons ao redor do núcleo estão espalhados em áreas chamadas orbitais atômicos, cuja forma e extensão dependerão do nível de energia dos elétrons e do momento angular.
Tanto a energia quanto o momento angular do elétron ao redor do núcleo têm certos valores permitidos, portanto, diz -se que eles são quantificado.
A equação de onda Schrödinger prevê quais valores de energia e momento angular são permitidos, bem como a função de onda associada a cada nível de energia e momento.
O quadrado matemático da função de onda determina os orbitais, ou seja, as áreas ao redor do núcleo onde os elétrons podem ser encontrados mais prováveis.
O tamanho do átomo
Para ter uma imagem em escala do modelo atômico atual, vamos imaginar que um átomo tem um diâmetro como o de um campo de futebol. O núcleo seria como uma formiga no centro do campo, mas surpreendentemente com 99,9% da massa atômica.
Por outro lado, os elétrons seriam como jogadores fantasmagóricos difusos em todo o campo, com maior probabilidade de ser encontrado no meio -campo.
Pode atendê -lo: variável categórica: características e exemplosExistem alguns alinhamentos ou maneiras permitidas de ocupar o campo, que dependem da energia dos jogadores (elétrons) e da quantidade de "turno" ou giram ao redor do centro.
O modelo atômico atual postula
1.- O elétron é caracterizado por sua massa m, por sua rotação s E por ser a partícula do transportador de carga negativa elementar (-e).
2.- Os elétrons têm comportamento duplo em forma de onda, mas dependendo de sua energia e da escala do fenômeno pode ser mais preponderante do que o outro.
3.- Os elétrons cercam o núcleo atômico positivo, de modo que garantem a neutralidade elétrica do átomo. Portanto, a quantidade de elétrons é igual à dos prótons; este é ele número atômico, que confere as características químicas e físicas de cada elemento.
4.- A interação entre elétrons e núcleo é modelada por potencial V (r) Eletrostático de Coulomb, que é incorporado no termo energia potencial no operador Hamiltoniano.
5.- O termo de energia cinética no operador Hamiltonian é um operador que é construído a partir do operador de momento linear, sendo o mesmo:
p = - i ħ ∂ /∂r
Onde ħ é a constante de Planck dividida por 2π.
6.- O operador Hamiltoniano H = (P⋅p)/2m - E V (r) agir na função de onda eletrônica ψ (r).
7.- Como são solicitadas as soluções estacionárias da função de onda eletrônica, é usada a equação independente de Schrödinger do tempo:
H ψ (r) = E ψ (r)
Onde e representa a energia total do elétron.
8.- Em átomos com vários elétrons, a interação entre eles não é levada em consideração.
9.- Quando se trata de átomos de muitos elétrons, os orbitais dos elétrons mais externos são modelados pelo potencial do núcleo blindado pelos elétrons mais internos, que é conhecida como potencial de Debye.
10.- A equação (7) tem uma solução para alguns valores de energia discreta, de modo que celebridades Quantos de Planck, Eles naturalmente aparecem das soluções de equação de Schrödinger.
Pode servir a você: ondas estacionárias: fórmulas, características, tipos, exemplosonze.- Para cada valor discreto, existe uma função de onda. Mas algumas soluções são degeneradas, dependendo do valor do momento angular l.
12.- A função de onda é o produto de uma função radial, a função azimutal e a função polar.
13.- Esta função de onda determina as regiões permitidas para o elétron. O quadrado da função de onda é o densidade de probabilidade Para encontrar o elétron em uma certa posição, vista do centro do núcleo atômico.
14.- O spin não aparece na equação de Schrödinger, mas é incorporado ao modelo atômico através do princípio de Pauli:
O elétron é um férmion com dois estados possíveis de spin +½ e -½.
Portanto, o mesmo estado caracterizado por números quânticos n, l, m da equação de Schrödinger, pode ser ocupado no máximo por 2 elétrons com opostos opostos opostos opostos. Dessa maneira, o Espin se torna o quarto número quântico.
Cientistas influentes no modelo atômico atual
Parece incrível, mas a maioria dos físicos que contribuíram para o modelo atômico atual aparece na mesma foto. Eles se reuniram nas famosas conferências patrocinadas por Ernest Solvay, um químico e industrial de origem belga, que se tornou famosa no mundo da ciência.
Eles começaram a ser realizados desde 1911 e reuniram os maiores cientistas do momento, entre eles praticamente todos aqueles que deram sua contribuição ao atual modelo atômico.
O mais famoso dessas conferências foi realizado em Bruxelas em 1927 e lá essa fotografia histórica foi tirada:
 Figura 3. 1927 Participantes da Conferência Solvay em Bruxelas. Fonte: Wikimedia Commons.
Figura 3. 1927 Participantes da Conferência Solvay em Bruxelas. Fonte: Wikimedia Commons.  Figura 4. Os participantes da conferência Solvay 1927.
Figura 4. Os participantes da conferência Solvay 1927. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Donder Théophile
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Temile VersChaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max Born
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels Bohr
- Owen Williams Richardson
Artigos de interesse
Modelo Atômico de Schrödinger.
Modelo Atômico de Broglie.
Modelo Atômico de Chadwick.
Modelo Atômico de Heisenberg.
Modelo atômico de perrina.
Modelo Atômico de Thomson.
Modelo atômico de Dalton.
Modelo Atômico Dirac Jordan.
Modelo Atômico do Demócrito.
Modelo Atômico de Leucipo.
Modelo atômico Bohr.
Referências
- Alonso - Finn. Fundações quânticas e estatísticas. Addison Wesley.
- Bauer, w. 2011. Física para engenharia e ciências. Volume 1. Mc Graw Hill.
- Eisberg e Resnick. Física quântica. Limusa - Wiley.
- Wikipedia. Teoria atômica. Recuperado de: é.Wikipedia.com
- Zapata f. Modelo tipocuântico do átomo. Recuperado de: Lifer.com

