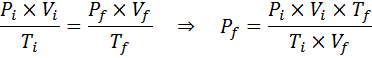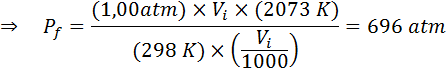Lei Geral de Gases

- 949
- 247
- Gilbert Franecki
Qual é a lei geral de gás?
O Lei Geral de Gases, Às vezes também chamado de lei combinada de gases, é a combinação das leis de Boyle, Charles e Gay-Lussac. É uma lei que descreve a relação entre a pressão, a temperatura e o volume de uma quantidade fixa de um gás ideal.
A declaração desta lei diz:
“Se o número de moles de um gás for constante, a relação entre o volume de pressão e o produto de temperatura permanece constante."
Na forma matemática, a lei geral dos gases é expressa da seguinte forma:
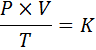
Onde p representa a pressão do gás, v seu volume, T sua temperatura absoluta e k é uma constante de proporcionalidade, cujo valor depende da quantidade de gás atual e das unidades nas quais as outras variáveis são expressas.
Formas alternativas da lei geral de gás
Como uma lei de proporcionalidade
Uma maneira alternativa de enunciar a lei geral dos gases é na forma de uma lei da proporcionalidade:
"Para qualquer quantidade fixa de gás, o produto de sua pressão e seu volume é diretamente proporcional à temperatura".
Isto quer dizer que:
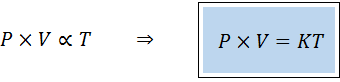
Isso equivale a multiplicar os dois membros da primeira equação por temperatura.
Relação entre o estado inicial e final
Como as leis de Boyle, Charles e Gay-Lussac, a lei geral de gás pode ser expressa como uma relação entre o estado inicial e o estado final de um gás que sofre uma mudança de estado.
Ao contrário das leis anteriores, não é necessário que nenhuma das três variáveis permaneça constante, apenas o número de toupeiras. Ou seja, a relação PXV/T será a mesma no estado inicial, Yo, E no estado final, F. Em outras palavras, a lei geral de gás também pode ser expressa matematicamente como:
Pode atendê -lo: ácido pícrico: o que é, estrutura, síntese, propriedades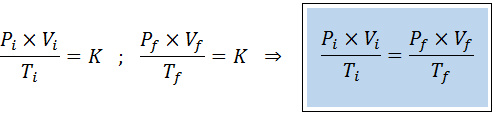
Derivação da fórmula da lei geral de gás
Como mencionado acima, a lei geral de gás vem da combinação das leis de Boyle, Charles e Gay-Lussac. Essas leis são apresentadas abaixo:
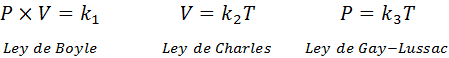
Se de cada uma dessas leis, limpamos a constante k, E então nós os multiplicamos, obtemos:
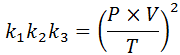
Agora, levando a raiz quadrada nos dois membros, a lei geral de gás é obtida:
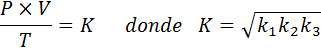
A lei geral dos gases vs. A lei dos gases ideais
A lei geral dos gases com a lei ideal de gases não deve ser confundida. Apesar de serem duas leis muito semelhantes e também intimamente relacionadas, a lei geral de gás combina apenas as leis de Boyle, Charles e Gay-Lussac.
Por sua vez, a lei ideal para gases acrescenta o princípio de Avogadro, segundo o qual "Volumes iguais de gases diferentes medidos nas mesmas condições de temperatura e pressão, contêm o mesmo número de partículas ”.
Como conseqüência, além de relacionar a temperatura, volume e pressão, a lei do gás ideal também permite que essas variáveis estejam relacionadas ao número de partículas ou aos moles de um gás, por isso representa a equação de estado do status do status do Gases ideais.
Nas equações a seguir, a diferença entre essas duas leis pode ser observada mais facilmente:

Observe que a principal diferença entre ambas as leis é que a lei de gase ideal inclui n, o que representa o número de moles, e também em vez da constante K, tem A constante r que é a constante dos gases ideais.
Pode atendê -lo: TerpenosPoderíamos dizer que a lei ideal para gases é mais geral que a lei geral de gás, pois pode ser aplicada para qualquer quantidade de gás sob qualquer conjunto de pressão, temperatura e condições de volume. Por outro lado, a aplicação da lei geral de gás exige que a quantidade de gás permaneça constante.
Exemplos da aplicação da lei geral de gás
Abaixo estão alguns exemplos de problemas típicos nos quais a lei geral de gás pode ser aplicada:
Exemplo 1: uma bolha de ar subaquática
Suponha que um mergulhador que esteja a uma profundidade de 20 m sob a água, onde a pressão é de 3,00 atm e a temperatura é de 15 ° C libera uma lufada de ar e uma das bolhas tem um volume inicial de 100 cm3.
Determine o volume da bolha de ar quando atingir a superfície que está em condições de temperatura e pressão padrão, assumindo que a quantidade de ar dentro da bolha não muda à medida que sobe.
Solução
Primeiro, devemos extrair todos os dados da declaração. Entende -se que existem dois estados diferentes para gás, uma inicial e uma extremidade, por isso separamos os dados em dois grupos. Também é necessário converter temperaturas em temperatura absoluta:

Como o problema especifica que não há alteração na quantidade de gás (o ar), podemos aplicar a lei geral de gás, a partir da qual podemos limpar o volume final:
Pode atendê -lo: Rodio: História, Propriedades, Estrutura, Usos, Risco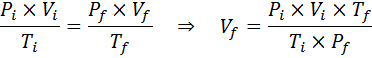
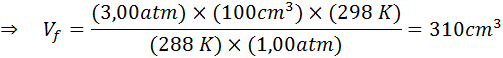
Portanto, a bolha de ar atinge um volume de 310 cm3 Ao atingir a superfície.
Exemplo 2: Alta pressão
Quanto a pressão de um gás ideal que está a uma temperatura ambiente de 25 ° C e uma pressão de 1,00 atm e comprime o milésimo de seu volume ao mesmo tempo aquece até 1800 ° C em um recipiente selado?
Solução
Como antes, começamos extraindo os dados:

Como diz que o processo é realizado em um recipiente selado, a quantidade de gás não muda, para que a lei geral de gás possa ser aplicada: