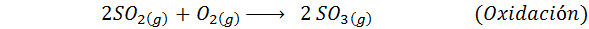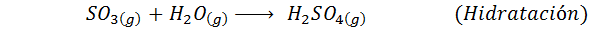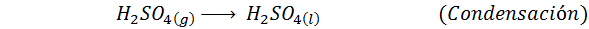Ácido sulfúrico (H2SO4)

- 2717
- 155
- Gilbert Franecki
Explicamos o que o ácido sulfúrico, sua estrutura química, propriedades, como é obtido, aplicações e riscos de uso são
 Barcos de ácido sulfúrico (H2SO4)
Barcos de ácido sulfúrico (H2SO4) O que é ácido sulfúrico?
Ele ácido sulfúrico, Também chamado de sulfato de hidrogênio e óleo de vitríolo, é um ácido de enxofre oxacídeo formado pela reação de anidrido sulfúrico (então3) e água. Sua fórmula molecular é H2SW4 E é, de longe, o ácido mineral mais produzido e usado.
É um ácido mineral forte e altamente corrosivo que é miscível com a água para que possa ser preparado na forma de soluções de quase qualquer concentração entre 0 e cerca de 18 molares.
Os altos volumes de produção e consumo deste composto são devidos a suas múltiplas aplicações nas indústrias tão variadas quanto a agricultura, a indústria petroquímica, na síntese orgânica e inorgânica e no tratamento de águas residuais, apenas para citar apenas alguns.
Estrutura do ácido sulfúrico
O ácido sulfúrico é formado por um átomo central de enxofre com Valência VI, cercado por 4 átomos de oxigênio, dois dos quais estão ligados a átomos de hidrogênio. Sua estrutura de Lewis é apresentada abaixo:
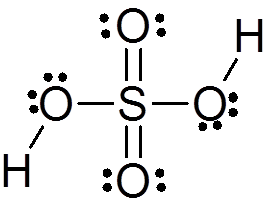
Como você pode ver, o enxofre neste composto é cercado por 12 elétrons (6 pares), por isso representa uma das exceções da regra do octeto.
Estando cercado por 4 átomos, a teoria da repulsão dos pares de elétrons de Valência (Trepev) prevê que esse composto deve assumir uma geometria aproximadamente tetraédrica, que é mostrada na seguinte imagem:
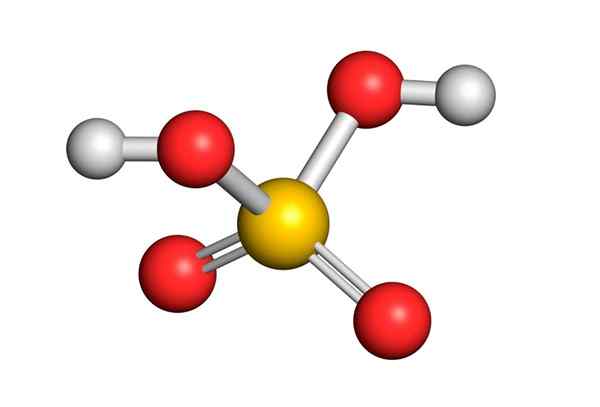
Devido à alta eletronegatividade do oxigênio e às diferentes estruturas de ressonância que o ácido sulfúrico pode ter, as ligações entre oxigênio e hidrogênios são fortemente polarizadas, o que os torna muito ácidos e fáceis de dissociar hidrogênios.
Propriedades do ácido sulfúrico
Como conseqüência de sua estrutura, o ácido sulfúrico tem as seguintes propriedades físicas e químicas:
Pode servir a você: epóxido: nomenclatura, obtenção, aplicações, exemplosPropriedades físicas
- O ácido sulfúrico puro é um líquido incolor e vaso sanitário que tem uma densidade de 1.8302 g/ml.
- Seu ponto de fusão é 10,31 ° C e a ebulição é de 337 ° C, embora a temperatura tenda a decompor produzir água e anidrido sulfúrico (também chamado de trióxido de enxofre).
- É completamente miscível com água, para que você possa preparar soluções com qualquer concentração. No entanto, soluções com mais de 98,3% na massa desse ácido são instáveis e o ácido se decompõe até que sua concentração diminua para 98,3%. Esta solução é estável e é conhecida como ácido sulfúrico concentrado.
- Em seu estado puro ou concentrado, é um líquido mais viscoso que a água.
Propriedades quimicas
- O ácido puro sulfúrico é uma substância fortemente oxidante e corrosiva. Tem a capacidade de oxidar, desidratar e sulfonar a uma ampla variedade de compostos orgânicos e carbonizar outros.
- É um forte ácido dirótico que perde completamente seu primeiro próton, dissolvendo -se na água, tornando -se sua base conjugada, o íon bissulfato (HSO4-). Este íon também é um ácido, embora mais fraco que o ácido original.
- As soluções aquosas de ácido sulfúrico são fortemente ácidas e são capazes de dissolver muitos metais, gerando hidrogênio gasoso. Eles também são capazes de neutralizar completamente bases fortes.
- Reage violentamente com muitos álcoois e água, liberando grandes quantidades de calor no processo.
Como o ácido sulfúrico é obtido?
Os três processos de produção de ácido sulfúrico mais conhecidos são: o processo de contato, o processo de ácido sulfúrico úmido e o processo de câmeras de chumbo.
1. Síntese de ácido sulfúrico pelo processo de contato
Este é o método mais usado hoje para produzir ácido sulfúrico. O processo consiste em 5 etapas em que o enxofre elementar se torna dióxido de enxofre (então2), então o trióxido de enxofre (então3), ácido dissulfúrico (H2S2QUALQUER7) e, finalmente, em ácido sulfúrico. As reações envolvidas são:
Pode atendê -lo: qual é o rombus de segurança e para que é?
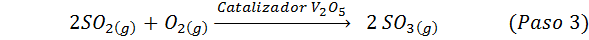


A segunda etapa do processo simplesmente consiste na purificação do dióxido de enxofre antes de ser convertido em enxerto de enxofre ou sulfúrico. A reação da terceira etapa ocorre quando o dióxido de enxofre gasoso entra em contato com um catalisador sólido de pentaxido de vanádio (v2QUALQUER5), E é por isso que o método é chamado de processo de contato.
2. Síntese de ácido sulfúrico pelo processo úmido
Este processo foi projetado para purificar os gases de emissão de uma ampla variedade de indústrias e plantas químicas. O subproduto desta purificação é o ácido sulfúrico de grau comercial, além do vapor de água quente, que pode ser reutilizado no processo industrial original.
No caso do processo úmido, as reações são principalmente. As reações importantes que ocorrem em cada estágio são:
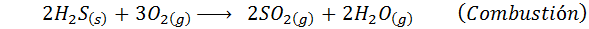
3. Síntese de ácido sulfúrico pelo processo de câmeras de chumbo
Este é um método antigo para produzir ácido sulfúrico que é usado hoje muito pouco. O processo foi queimar enxofre elementar na presença de oxigênio do ar em câmaras de madeira revestidas com chumbo e, portanto, seu nome.
Após essa combustão, o dióxido de enxofre reage com óxidos de nitrogênio produzidos pela decomposição de nitrato de sódio ou por outros meios. No final, após uma série de reações adicionais, o ácido sulfúrico foi obtido.
Pode servir você: frasco de fundo planoAplicações comuns
- A principal aplicação do ácido sulfúrico é como fonte de enxofre na forma de sulfatos na fabricação de fertilizantes. De fato, cerca de 60% do ácido sulfúrico produzido no mundo é destinado a esse fim.
- Na indústria química, é usado para a síntese de detergentes, pigmentos, catalisadores para a indústria petroquímica e no processamento de minerais para obter diferentes metais.
- Finalmente, o ácido sulfúrico é o eletrólito usado nas baterias de chumbo usadas na maioria dos carros.
Riscos associados ao ácido sulfúrico
Devido às suas propriedades químicas, o ácido sulfúrico pode ser muito perigoso para os seres humanos e os animais e para o meio ambiente em geral. Estes são alguns dos riscos associados a este produto químico:
- Suas características corrosivas e desidratantes tornam o ácido puro causar grandes danos se entrar em contato com a pele.
- Por outro lado, a reação de soluções aquosas de ácido sulfúrico com metais gera hidrogênio gasoso, que é uma substância combustível e explosiva.
- O próprio ácido sulfúrico não sofre uma reação de combustão, mas, sendo um forte oxidante, estimula a combustão de outras substâncias, agindo como uma espécie de catalisador, por isso representa um risco considerável de incêndio.
- Além disso, quando exposto ao fogo, pode ser dividido em gases tóxicos e gerar vapores de ácido sulfúrico que podem destruir facilmente as vias aéreas.
Por esses motivos e muito mais, o ácido sulfúrico é uma substância que deve ser tratada com cuidado.