Lei de Henry

- 2622
- 590
- Orlando MacGyver
 A lei de Henry explica a efervescência de refrigerantes
A lei de Henry explica a efervescência de refrigerantes Qual é a lei de Henry?
O Lei de Henry É o relacionamento que descreve o efeito da pressão na solubilidade do gás. Esta lei estabelece que a solubilidade de um gás em contato com a superfície de um líquido a uma determinada temperatura é diretamente proporcional à pressão parcial do referido gás no líquido.
Isso significa que, quanto maior a pressão do gás em um líquido, maior a quantidade total de gás que pode ser dissolvida nele, obtendo assim uma concentração maior (ou seja, maior a solubilidade).
Lei de Henry Vemos isso em ação toda vez que descobrimos uma bebida de refrigerante. Sendo fechado, alta pressão dentro da garrafa mantém o gás carbônico dissolvido. Mas, descobrindo -o, a pressão do gás diminui, o que reduz sua solubilidade e escapa formando bolhas e efervescência.
Fórmula da lei de Henry
Na forma matemática, a lei de Henry é expressa como uma lei da proporcionalidade:
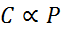
Esta lei de proporcionalidade é transformada em:
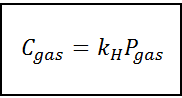
Onde C Refere -se à concentração máxima de gás no líquido, ou seja, sua solubilidade; Pgás É a pressão parcial do gás em contato com o líquido e kH É uma constante de proporcionalidade chamada Lei de Henry constante.
A concentração de gás pode ser expressa em diferentes unidades, como molaridade, moleidade ou fração molar. No entanto, na maioria dos casos, os produtos químicos usam a concentração em unidades de molaridade (em mol/l), enquanto a pressão é expressa em atmosferas.
Pode atendê -lo: antraceno: o que é, estrutura, propriedades, usosA constante da lei de Henry (kH)
A constante kH Descreva as interações entre um gás e um solvente. Quanto mais fortes essas interações são, maior a constante e, portanto, maior a solubilidade do gás no solvente a uma certa temperatura e pressão.
Numericamente, o valor de kH representa a solubilidade do gás à temperatura fornecida, quando a pressão parcial do mesmo é 1 atm.
Dependendo das unidades de concentração e pressão usadas na equação, essa constante pode ter unidades mol/l.atm, mol/kg.atm, etc.
A tabela a seguir mostra os valores da constante da lei de Henry para alguns gases comuns na água a 25 ° C:

Esses valores diminuem com a temperatura, uma vez que a solubilidade dos gases em geral diminui a uma temperatura mais alta.
Explicação da lei de Henry
A lei de Henry é muito fácil de entender do ponto de vista microscópico. Podemos imaginar um gás como um conjunto de partículas muito pequenas saltando em todas as superfícies que jogam. Quando colidem com a superfície de um líquido, algumas partículas saltam, enquanto outras atravessam a superfície sendo presa (ou seja, elas se dissolverão).
O mesmo vale para partículas de gás que são dissolvidas. Eles saltam com as paredes do recipiente e também podem atingir a superfície do líquido, onde alguns saltam enquanto outros atravessam a superfície e escaparão para a fase gasosa.
Quando o equilíbrio é alcançado, as velocidades com as quais o gás se dissolve no solvente e com o qual escapa são iguais, de modo que a concentração permanece constante.
Pode atendê -lo: propriedades mecânicas de metais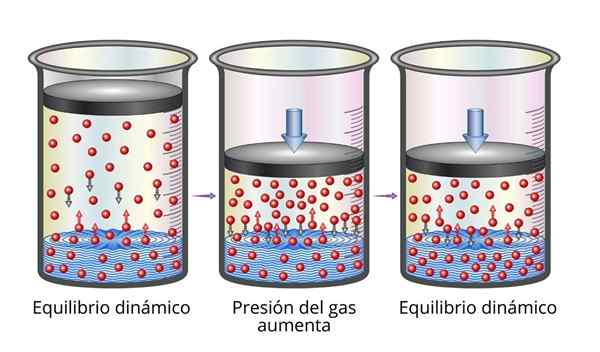 Explicação da lei de Henry
Explicação da lei de Henry Quando aumentamos a pressão do gás, o que estamos fazendo é aumentar a frequência com que as partículas de gás colidem com a superfície líquida. Isso faz a velocidade com que o gás se dissolve aumenta. Quando um novo equilíbrio é alcançado, a nova concentração de gás será maior.
Exceções à lei de Henry
É importante destacar que a lei de Henry é uma lei ideal, que apenas descreve o comportamento das soluções reais de gás sob certas condições. Assim, a lei de Henry só pode ser aplicada quando:
- A temperatura permanece constante.
- O gás está em equilíbrio com a solução.
- A pressão do gás é relativamente baixa.
- O gás não reage com o solvente.
Apesar disso, mesmo em alguns casos em que o gás reage com o solvente, esta lei pode ser aplicada aproximadamente.
Exemplos de aplicação da lei de Henry
Exemplo 1: Determinação da constante da lei de Henry
Foi determinado experimentalmente que a concentração de uma solução aquosa em equilíbrio com neon a uma pressão de 3,00 atm e 25 ° C é 0,00135 mol/L. Determine a constante da lei de Henry para neon em água a 25 ° C.
Solução:
De acordo com a lei de Henry:
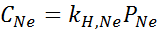
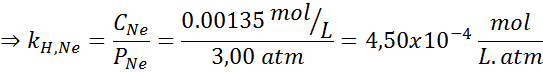
Portanto, a lei de Henry constante para neon em água a 25 ° C é 4,50 × 10-4 mol/l.Atm.
Exemplo 2: Determinação da solubilidade de um gás
Usando a constante da lei de Henry fornecida na tabela anterior, determine a solubilidade do dióxido de carbono do ar na água no nível do mar, sabendo que a fração molar do referido gás no ar é de 3,14 × 10-4.
Solução:
No nível do mar, a pressão do ar é de 1 atm e a pressão parcial do CO2 É dado por:
Pode servir a você: ácido hipóiodoso (HIO)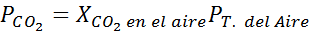
Substituindo essa expressão na lei de Henry:
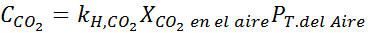
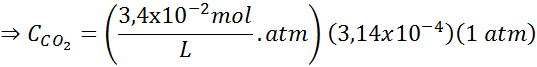
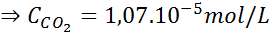
Exemplo 3: gases de mergulho
Quando um mergulhador nada em profundidades superiores a 30 metros, uma mistura de ar deve respirar com outros gases inertes, como hélio ou argônio, uma vez que o aumento da concentração de nitrogênio no sangue previsto pela lei de Henry tem efeitos narcóticos que causam desorientação, confusão e visão problemas.
Este efeito começa a observar ao respirar ar (xN2= 0,78) a uma pressão de 4,00 atm. Se um mergulhador planeja descer até 100 metros de profundidade, onde a pressão é de cerca de 11,0 atm, qual é a fração máxima de nitrogênio que pode respirar antes de sofrer de traficantes de drogas?
Solução:
Com base na declaração, podemos deduzir que a concentração máxima de nitrogênio é o que ocorre quando a pressão do ar é de 4,00 atm. De acordo com a lei de Henry e usando a relação entre pressão total e pressão parcial do exemplo anterior:
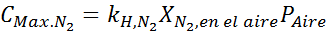
Esta deve ser a mesma concentração máxima a qualquer pressão total. Então, 100 metros:
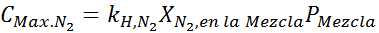
Equalizando as duas equações, podemos encontrar a fração molar máxima de nitrogênio na mistura:
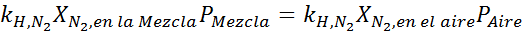
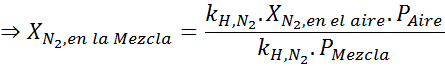
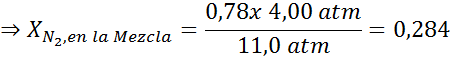
Isso significa que o mergulhador não deve usar uma mistura contendo mais de 28,4% de nitrogênio se planeja mergulhar até 100 metros de profundidade.

