Lei de Boyle
- 1065
- 24
- Shawn Leffler
Qual é a lei de Boyle?
O lei de Lei Boyle ou Boyle-Maleotte É aquele que expressa a relação entre a pressão exercida por ou sobre um gás e o volume que isso ocupa; mantendo constantemente a temperatura do gás, bem como sua quantidade (número de toupeiras).
Esta lei, juntamente com a de Charles, Gay-Lussac, Charles e Avogadro, descreve o comportamento de um gás ideal; Especificamente, em um recipiente fechado sujeito a mudanças de volume exercidas por uma força mecânica.
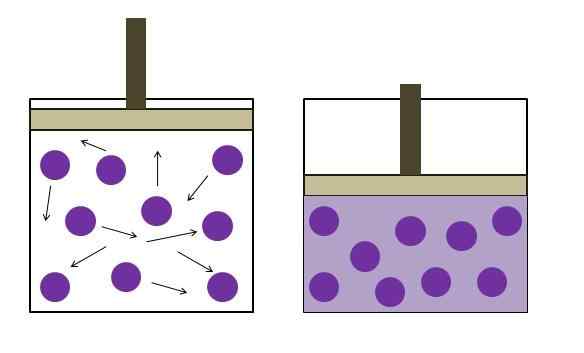
 Aumento da pressão de redução de pressão. Fonte: Gabriel Bolívar
Aumento da pressão de redução de pressão. Fonte: Gabriel Bolívar A imagem superior resume brevemente a lei de Boyle. Pontos roxos representam moléculas ou átomos de gás, que colidem com as paredes internas do recipiente (esquerda). Ao diminuir o espaço ou o volume disponível do recipiente ocupado por esse gás, as colisões são aumentadas, o que se traduz em um aumento na pressão (direita).
Isso mostra que a pressão de P e Volume V do gás é inversamente proporcional se o contêiner estiver bem fechado; caso contrário, maior pressão seria igual a uma maior dilatação do recipiente.
Se um gráfico V contra P, com os dados de V e P nos eixos e x, respectivamente, fosse observado, uma curva assintótica seria observada. Quanto mais baixo V, maior o aumento de p; Isto é, a curva se estenderá em direção a altos valores de P no eixo x.
Obviamente, a temperatura permanece constante; Mas, se o mesmo experimento fosse realizado em temperaturas diferentes, as posições relativas dessas curvas V vs p mudariam no eixo cartesiano. A mudança seria ainda mais evidente se fosse gráficos em um eixo tridimensional, com constante t no eixo z.
História da Lei de Boyle
Fundo
Como o cientista Galileu Galilei expressou sua crença na existência do vazio (1638), os cientistas começaram a estudar as propriedades do ar e lacunas parciais.
O químico angloirlandês, Robert Boyle, iniciou seu estudo de propriedades aéreas em 1638 ao saber que Otto von Guericke, um engenheiro alemão e engenheiro físico, havia construído uma bomba aérea.
Pode atendê -lo: bromo: história, estrutura, configuração eletrônica, propriedades, usosExperiência de Mercúrio
Para realizar seus estudos de pressão do ar, Boyle usou um tubo de forma "j", cuja construção foi atribuída a Robert Hooke, um assistente de Boyle. A extremidade curta do braço foi selada, enquanto a extremidade longa do braço do tubo estava aberta para colocar o mercúrio.
Desde o início, Boyle queria estudar a elasticidade do ar, qualitativa e quantitativa. Quando Mercúrio derramou pela extremidade aberta do tubo na forma de "J", Boyle deduziu que o ar no braço curto do tubo foi contraído sob a pressão de Mercury.
Resultados
Quanto maior a quantidade de mercúrio adicionada ao tubo, maior a pressão exercida no ar e menor seu volume. Boyle obteve um gráfico exponencial negativo do volume de ar, dependendo da pressão.
Enquanto isso, se o volume do ar contra a pressão inversa for plotado, há uma linha reta de inclinação positiva.
Em 1662, Boyle publicou a primeira lei física que foi dada na forma de uma equação, que indicava a dependência funcional de duas variáveis. Nesse caso, pressão e volume.
Boyle disse que havia uma relação inversa entre a pressão exercida em um gás e o volume ocupado esse gás, esse relacionamento relativamente verdade. A maioria dos gases se comportam como gases ideais para moderar pressões e temperaturas.
Quando ocorrem pressões mais altas e temperaturas mais baixas, os desvios do comportamento dos gases reais dos ideais se tornaram mais notáveis.
Edme Mariotte
O físico francês Edme Mariotte (1620-1684) descobriu independentemente a mesma lei em 1679. Mas ele tinha o mérito de mostrar que o volume varia com a temperatura. É por isso que é chamado de lei ou lei de Mariotte de Boyle e Mariotte.
Fortalecimento da lei
Daniel Bernoulli (1737) fortaleceu a lei de Boyle, apontando que a pressão de um gás é produzida pelos impactos das partículas de gás nas paredes do recipiente que o contêm.
Pode servir a você: nucleófilo: ataque nucleofílico, tipos, exemplos, nucleofilicidadeEm 1845, John Waterston publicou um artigo científico, que se concentra nos principais princípios da teoria cinética dos gases.
Posteriormente, Rudolf Clausius, James Maxwell e Ludqwig Boltzmann consolidaram a teoria cinética dos gases, que relaciona a pressão exercida por um gás com a velocidade das partículas de gás em movimento em movimento em movimento.
Quanto menor o volume do recipiente contendo um gás, maior a frequência dos impactos das partículas que o formam contra as paredes do recipiente; E, portanto, quanto maior a pressão exercida pelo gás.
O que é esta lei?
Os experimentos realizados por Boyle, apontam que há uma relação inversa entre o volume ocupado por um gás e a pressão exercida nele. No entanto, o relacionamento acima mencionado não é totalmente linear, conforme indicado por um gráfico de variação de volume de acordo com a pressão atribuída a Boyle.
Na lei de Boyle, é indicado que o volume ocupado por um gás é inversamente proporcional à pressão. Também é indicado que o produto da pressão de um gás por seu volume é constante.
Expressão matemática
Para chegar à expressão matemática da lei de Boyle, começa de:
V ∝ 1/p
Onde indica que o volume ocupado por um gás é inversamente proporcional à sua pressão. No entanto, há uma constante que determina o quão inversamente proporcional é esse relacionamento.
V = k/p
Onde k é a proporcionalidade constante. Limpando k você tem:
Vp = k
O produto da pressão de um gás por seu volume é constante. Então:
V1P1 = K e v2P2 = k
E isso pode ser deduzido que:
V1P1 = V2P2
O último é a expressão ou equação final para a lei de Boyle.
Para que serve? Que problemas a lei de Boyle resolve?
Motores a vapor
A lei de Boyle-Maleotte é aplicada na operação de máquinas a vapor. É um motor de combustão externo que usa a transformação da energia térmica de uma quantidade de água em energia mecânica.
A água é aquecida em uma caldeira bem fechada, e o vapor produzido exerce pressão de acordo com a lei de Boyle que produz uma expansão de um volume de cilindros empurrando um pistão.
Pode atendê -lo: fator de diluiçãoO movimento linear do pistão é transformado em um movimento rotacional, usando uma manivela e o sistema de manivela, que pode acionar as rodas de uma locomotiva ou o rotor de um gerador elétrico.
Bebidas bebidas
A ação de aspirar um refrigerante ou um suco de uma garrafa através de um tubo de plástico está relacionado à lei de Boyle. Quando o ar do tubo é sugerido usando a boca, há uma diminuição na pressão dentro do tubo.
Essa queda de pressão facilita o movimento ascendente do fluido no tubo, permitindo sua ingestão. Esse mesmo princípio funciona em extração sanguínea usando uma seringa.
Sistema respiratório
A lei de Boyle está intimamente relacionada ao funcionamento do sistema respiratório. Durante a fase de inspiração, ocorre a contração do diafragma e outros músculos; Por exemplo, intercostais externos que produzem uma expansão da caixa torácica.
Isso causa uma diminuição na pressão intrapleural, causando uma expansão pulmonar que produz um aumento no volume pulmonar. Portanto, a pressão intrapulmonar diminui de acordo com o que é levantado na lei de Boyle.
Ao se tornar subatose a pressão intrapulmonar, o ar atmosférico flui nos pulmões, que produz um aumento na pressão nos pulmões; Assim, correspondendo à sua pressão à pressão atmosférica e concluindo a fase de inspiração.
Posteriormente, os músculos inspiratórios relaxam e os músculos expiratórios se contraem. Além disso, é produzida retração pulmonar elástica, um fenômeno que produz uma diminuição no volume pulmonar, com um consequente aumento da pressão intrapulmonar, explicável pela lei de Boyle.
Ao aumentar a pressão intrapulmonar e se tornar maior que a pressão atmosférica, o ar flui dentro dos pulmões para a atmosfera. Isso ocorre até que as pressões sejam iguais, o que conclui a fase de expiração.
Referências
- Lei de Boyle. Encyclopædia britannica. Recuperado de: Britannica.com
- A fórmula da lei de Boyle. Recuperado de: pensamento.com

