Lei Avogadro
- 2004
- 477
- Shawn Leffler
Qual é a lei de Avogadro?
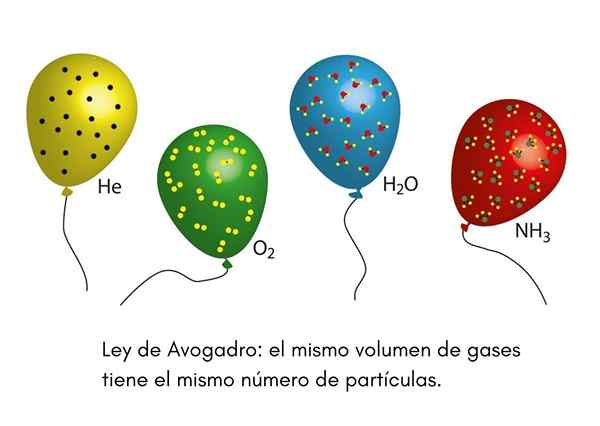
O Lei Avogadro, Também chamado de Princípio Avogadro, é uma lei que se aplica aos gases ideais e foi enunciada por um cientista do século XIX chamado Amadeo Avogadro. Esta lei estabelece que dois volumes iguais de gases diferentes que estão nas mesmas condições de temperatura e pressão conterão o mesmo número de partículas gasosas.
Isso significa que, se tivermos dois balões, um cheio de hélio e outro com oxigênio, e ambos os balões têm o mesmo volume, a mesma pressão e a mesma temperatura, haverá o mesmo número de átomos de hélio gasosos no primeiro globo que moléculas de oxigênio no segundo.
Fórmula da Lei Avogadro
Outra maneira de declarar a lei de Avogadro é dizer que, se for mantida pressão e temperatura constantes, o volume de um gás será proporcional ao número de toupeiras. Isso é representado de uma maneira matemática como:
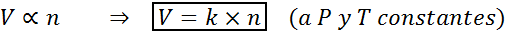
Esta fórmula pode ser reorganizada para v/n = k, isto é, que a relação entre o volume e o número de toupeiras permanece constante sempre que P e T são constantes.
Portanto, se introduzirmos ou removermos uma certa quantidade de gás de um recipiente que mantém P e T constante, o volume mudará e o estado inicial e final será relacionado por meio da seguinte equação:

Condições sob as quais a lei de Avogadro é cumprida
Esta lei se aplica exatamente aos gases ideais. Estes são gases formados por partículas específicas (que não ocupam um volume no espaço) que não interagem entre si de forma alguma.
Pode servir a você: Biodiesel: História, Propriedades, Tipos, Vantagens, DesvantagensComo o nome indica, esse tipo de gase não existe na realidade, mas em nossa imaginação. Eles são uma "idéia" simplificada do que acreditamos ser um gás. No entanto, existem algumas condições sob as quais um gás real, como o ar, se comporta idealmente: a pressões muito baixas e a temperaturas muito altas.
As baixas pressões fazem com que o volume ocupado pelas partículas de gás seja insignificante em comparação com o tamanho do recipiente, enquanto as altas temperaturas fazem com que as partículas se movam tão rápido que não têm tempo para interagir quando se cruzam.
Sob essas condições, a maioria dos gases encontra a lei de Avogadro com boa precisão.
Importância da lei de Avogadro
Uma das contribuições mais importantes da lei de Avogadro foi que ela permitiu demonstrar a existência de gases elementares formados por mais de um átomo como o o2 ou h2. Isso contribuiu para o avanço da teoria atômica.
Además, la ley de Avogadro complementa a las leyes de los gases de Boyle, Charles y Gay-Lussac, y al combinarla con estas tres leyes, la ley de Avogadro permite derivar la ley de los gases ideales, una de las leyes más importantes en a química.
Por outro lado, a lei de Avogadro também permite estabelecer relações entre pesos moleculares de diferentes gases, pois implica que a massa de volumes iguais de diferentes gases medidos na mesma temperatura e pressão é proporcional à massa de cada partícula de cada gás.
Pode atendê -lo: nitrato de sódio (nano3): estrutura, propriedades, usos, riscosAssim, com amostras de arrependimento único de dois gases que ocupam volumes iguais à mesma temperatura e pressão, a relação entre suas massas molares pode ser obtida.
Exemplos da lei de Avogadro na vida cotidiana
Balões de festa
Nós já vimos um palhaço em uma festa infantil inflando balões de hélio para distribuí -los entre as crianças. Esses balões estão aproximadamente na mesma temperatura. Se dois balões de festas forem preenchidos com a mesma pressão e ambos têm o mesmo tamanho, a lei de Avogadro garante que ambos os balões tenham o mesmo número de toupeiras de hélio.
Por outro lado, se um dos balões for maior que o outro, terá um volume maior e, de acordo com a lei de Avogadro, terá uma quantidade maior de partículas de hélio dentro.
Os pneus de um carro
Independentemente de qual gás eles sejam preenchidos, os pneus nos lados opostos de um carro são sempre preenchidos com a mesma pressão final de cerca de 32 psi.
Além disso, sempre garantimos que ambas as borrachas sejam iguais, para que elas tenham o mesmo volume. Assim, de acordo com o princípio Avogadro, podemos dizer que os dois pneus conterão o mesmo número de partículas gasosas.
Uma seringa cheia de ar
Suponha que tenhamos uma seringa aberta e cheia de 50 cm3 de ar. Como está aberto, o interior da seringa e o exterior (os arredores) estão na mesma temperatura e pressão.
Agora, suponha que pressionemos o êmbolo da seringa e movês até 10 cm sejam lidos3. À medida que a seringa é descoberta, o ar escapa pela ponta à medida que o êmbolo se move, de modo que o número de partículas de ar dentro da seringa diminui junto com o volume.
Pode atendê -lo: volatilizaçãoComo nem a pressão nem a temperatura estão mudando, a lei Avogadro pode ser aplicada para relacionar o volume final com a quantidade de partículas de ar que permanecem dentro da seringa. Este relacionamento é:

Reorganizando esta equação, entendemos:
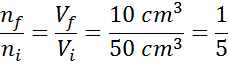
Este resultado significa que, se reduzirmos o volume dentro da seringa para o quinto, mantendo P e T constante, o número de toupeiras ou partículas presentes no final do final do processo também será a quinta parte do que originalmente.


