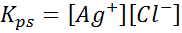Lei de Ação de Massa

- 1385
- 337
- Pete Wuckert
 Uma reação de precipitação envolve o equilíbrio da solubilidade, que é governada pela lei de ação em massa
Uma reação de precipitação envolve o equilíbrio da solubilidade, que é governada pela lei de ação em massa Qual é a lei de ação em massa?
O Lei de Ação de Massa afirma que a velocidade de uma reação depende da concentração de seus reagentes elevados aos seus coeficientes estequiométricos. Esta lei permite se relacionar com as concentrações no equilíbrio dos reagentes e produtos de uma reação química reversível. Em outras palavras, estabelece a fórmula da constante de equilíbrio.
A lei de ação em massa foi enunciada pelos químicos norueguês (e creme) Cato M. Guldberg (1836-1902) e Peter Waage (1833-1900) em 1864. Esta é uma das leis fundamentais da química, pois nos permite calcular as concentrações finais em equilíbrio a partir dos valores iniciais.
Além disso, a lei de massa também nos permite entender facilmente os efeitos das mudanças nas concentrações de qualquer uma das espécies em equilíbrio. Em outras palavras, nos permite entender como os princípios de Le Chatlier funcionam.
Apesar de ser chamado de "lei de ação em massa", ela realmente não se refere às massas dos reagentes e produtos, mas, em vez disso, às suas concentrações. A razão pela qual é chamado Lei de Ação de Massa e não a Lei da Ação das Concentrações é porque a concentração costumava ser chamada de "massa ativa".
A lei de ação em massa e a constante de equilíbrio
De acordo com a lei de ação em massa, quando as reações reversíveis atingem o equilíbrio, não é porque a reação para. Pelo contrário, o equilíbrio é alcançado quando a velocidade da reação direta é feita igual à velocidade da reação inversa. Quando isso acontece, todas as espécies químicas ocorrem e consumidas na mesma velocidade, para que suas concentrações se tornem constantes (elas param de mudar).
Pode atendê -lo: tolueno: estrutura, propriedades, usos, obtençãoGuldberg e Waage descobriram que as velocidades de ambas as reações (o direto e o inverso) dependem da concentração molar (em mol/L) de seus reagentes elevados aos coeficientes estequiométricos. A partir dessas observações, eles conseguiram encontrar a fórmula para a constante de equilíbrio.
De acordo com esta lei, para qualquer reação química reversível que atinja o equilíbrio,
“... a relação entre o produto das concentrações molares dos produtos elevados para seus coeficientes estequiométricos e o produto das concentrações molares dos reagentes elevados aos seus coeficientes estequiométricos é constante a uma certa temperatura."
Essa constante é chamada de "constante de equilíbrio" e é representada com o símbolo kc.
A fórmula constante de equilíbrio
Vamos ver como a declaração anterior parece na forma de uma equação matemática. É uma reação química reversível, como a apresentada abaixo, onde A e B são os reagentes, C e D os produtos, e A, B, C e D são os respectivos coeficientes estequiométricos da reação equilibrada:
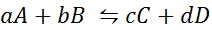
Para uma reação genérica como essa, a constante de equilíbrio é dada por:
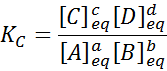
onde [a], [b], [c] e [d] são as concentrações molares de a, b, c e d em equilíbrio.
O equilíbrio constante nas pressões
A fórmula anterior para a constante de equilíbrio se aplica a qualquer reação química na qual todas as substâncias estejam na mesma fase (ou seja, que elas estão em fase aquosa ou em fase gasosa, por exemplo). No entanto, no caso de reações de fase gasosa, é mais conveniente trabalhar com pressões do que com concentrações.
Como a concentração molar de gases é proporcional à sua pressão parcial, a fórmula da constante de equilíbrio pode ser reescrita em termos dessas pressões, como segue:
Pode atendê -lo: 30 usos de ácidos carboxílicos na vida cotidiana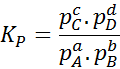
Onde pPARA, pB, pC E PD São as pressões parciais de A, B, C e D, respectivamente, e A, B, C e D continuam sendo os coeficientes estequiométricos. Nesse caso, kP É chamado de equilíbrio constante nas pressões e está relacionado a kC Através da seguinte fórmula:
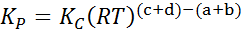
onde r é a constante universal dos gases ideais e t é a temperatura absoluta em Kelvin.
Reações envolvendo mais de uma fase
Às vezes, uma reação química envolve a formação de um sólido como precipitado de uma solução ou a formação de um líquido de reagentes que reagem em uma fase gasosa. Nesses casos, a reação não está acontecendo na mesma fase; portanto, devemos modificar a fórmula constante de equilíbrio.
Felizmente, as modificações são muito simples. A única coisa que devemos levar em consideração ao escrever a fórmula da constante de equilíbrio é que as substâncias puras que aparecem como sólidas ou líquidos não devem levar em consideração. Se necessário, em vez disso, colocamos um 1.
Em conclusão, a lei de ação em massa permite escrever a fórmula da constante de equilíbrio, tanto nas concentrações quanto nas pressões parciais. Ao conhecer um dos dois, o outro pode ser encontrado a partir do primeiro.
Finalmente, devemos ter cuidado e revisar a fase em que todas as espécies químicas são encontradas, para saber se devemos ou não incluí -las na constante de equilíbrio.
Exemplos do uso da lei de ação em massa
Nos exemplos a seguir, mostramos como usar a lei de ação em massa para escrever as fórmulas de constantes de equilíbrio para diferentes tipos de reações químicas.
Reações de reações no estado gasoso
Exemplo 1: A decomposição de n2QUALQUER4 em uma fase gasosa
Então2QUALQUER4 É um gás marrom que quebra de acordo com a seguinte reação:
Pode servir a você: ácido láúrico: estrutura, propriedades, usos, benefícios, efeitos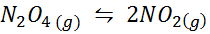
 Amostra NO2 em diferentes temperaturas mostrando o deslocamento do equilíbrio para o N2O4 marrom
Amostra NO2 em diferentes temperaturas mostrando o deslocamento do equilíbrio para o N2O4 marrom Para esta reação, as constantes de equilíbrio nas concentrações e pressões são dadas por:
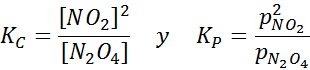
Exemplo 2: A oxidação do monóxido de carbono
O monóxido de carbono é um gás muito tóxico que pode se tornar dióxido de carbono ao reagir com oxigênio de acordo com a seguinte reação:
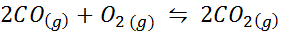
Para esta reação, as constantes de equilíbrio nas concentrações e pressões são dadas por:
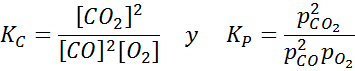
Saldos de base ácidos em fase aquosa
Exemplo 3: Auto -comprimento da água
O equilíbrio iônico de água, também conhecido como reação de auto -comprimento da água, é uma reação reversível entre duas moléculas de água em um estado líquido. A reação é:
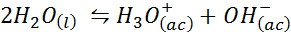
Ao escrever a constante de equilíbrio para essa reação, devemos levar em consideração que, neste caso, o único reagente é um líquido puro cuja concentração é praticamente constante. Por esse motivo, não está incluído na fórmula da constante de equilíbrio:
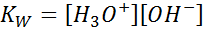
Esta é uma constante de equilíbrio muito importante que recebe seu próprio nome (constante do produto iônico da água) e seu próprio símbolo (kC. W refere -se à água em inglês, o que é dito banheiro). No entanto, é uma constante de equilíbrio em concentrações como qualquer outra.
Solubilidade
Exemplo 4: Balance de solubilidade de cloreto de prata
Quando preparamos uma solução saturada, um equilíbrio de solubilidade é estabelecido. Nesse caso, o equilíbrio é o da dissolução do cloreto de prata, cuja reação é dada por:
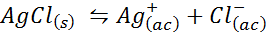
A constante de equilíbrio dessa reação (e de todas as reações da solução) não inclui cloreto de prata (AGCL), pois é um sólido. Além disso, como no caso da água, essas constantes também recebem um nome especial que é "constante do produto de solubilidade", representado como k$: