Carga formal
- 3348
- 1027
- Ernesto Bruen
Qual é a carga formal?
O Carga formal (CF) é aquele que é atribuído a um átomo de uma molécula ou íon, que permite explicar suas estruturas e propriedades químicas, dependendo disso. Esse conceito implica a consideração do caráter máximo de covalência no link A-B; isto é, o par de elétrons é compartilhado igualmente entre A e B.
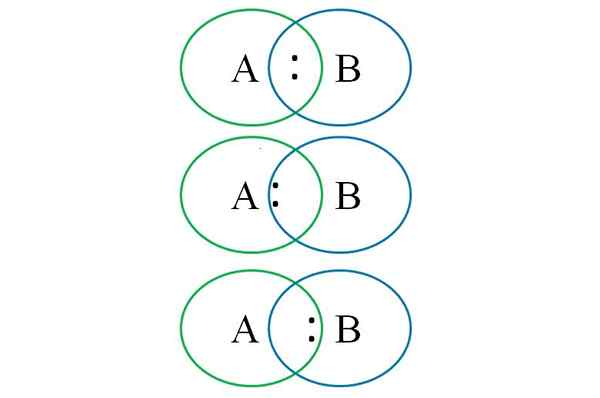
Para entender o exposto na imagem inferior, dois átomos vinculados são mostrados: um designado com a letra A e a outra com a letra B. Como pode ser visto, na interceptação de círculos, um link com o par é formado ":". Nesta molécula heteronuclear, se A e B tiverem igual eletronegatividade, o torque ":" permanece equidistante A tanto a quanto.

No entanto, dado que dois átomos diferentes não podem ter propriedades idênticas, o par ":" é atraído para o qual é mais eletronegativo. Nesse caso, se A for mais eletronegativo que B, o par “:” está mais próximo do de B. O oposto ocorre quando B é mais eletronegativo que A, agora se aproximando ":" A B.
Então, para atribuir cargas formais A e B, é necessário considerar o primeiro caso (aquele acima da imagem). Se o link puramente covalente A-B quebrasse, ocorreria uma separação homolítica, gerando radicais livres a · e · b.
Benefícios qualitativos do uso de carga formal
Os elétrons não são fixos, como no exemplo anterior, mas viajam e são perdidos pelos átomos da molécula ou íon. Se for uma molécula diatômica, sabe -se que o par “:” deve ser compartilhado ou vagando entre os dois átomos; O mesmo acontece em uma molécula do tipo A-B-C, mas com maior complexidade.
No entanto, quando um átomo é estudado e assume cem por cento de covalência em seus links, é mais fácil estabelecer se dentro do composto vence ou perde elétrons. Para determinar esse ganho ou perda, seu estado basal ou livre deve ser comparado ao seu ambiente eletrônico.
Pode servir a você: Lei de Amagat: Explicação, Exemplos, ExercíciosDessa forma, é possível atribuir uma carga positiva (+) se o átomo perder um elétron ou uma carga negativa (-) quando, pelo contrário, um elétron vencer (os sinais devem ser escritos dentro de um círculo).
Assim, embora os elétrons não possam ser localizados exatamente, essas cargas formais (+) e (-) nas estruturas são ajustadas na maioria dos casos para as propriedades químicas esperadas.
Isto é, a carga formal de um átomo está intimamente relacionada à geometria molecular de seu ambiente e reatividade dentro do composto.
Fórmula e como calculá -lo
São cargas formais atribuídas arbitrariamente? A resposta é não. Para isso, o ganho ou perda de elétrons deve ser calculado assumindo ligações puramente covalentes, e isso é alcançado através da seguinte fórmula:
Cf = (número do grupo de átomos) - (número de links dessa forma) - (número de elétrons descompactados)
Se o átomo tiver um CF com um valor de +1, uma carga positiva ( +) será atribuída; Enquanto você tiver um CF com um valor de -1, ele é atribuído uma carga negativa ( -).
Para calcular corretamente o CF, as etapas devem ser seguidas abaixo:
- Localize qual grupo é o átomo dentro da tabela periódica.
- Conte o número de links que se formam com seus vizinhos: os links duplos (=) valem dois e os links triplos valem três (≡).
- Finalmente, contando o número de elétrons não compartilhados, o que pode ser facilmente observado com estruturas de Lewis.
Variações de cálculo de acordo com a estrutura
Dada a molécula linear A-B-C-D, cargas formais para cada átomo podem variar se a estrutura, por exemplo, agora estiver escrita como: B-C-A-D, C-A-B-D, A-C-D-B, etc. Isso ocorre porque existem átomos que, compartilhando mais elétrons (formam mais ligações), adquirem CF positivo ou negativo.
Pode servir você: menisco (química)Então, qual das três possíveis estruturas moleculares corresponde ao composto ABCD? A resposta é: aquela que geralmente possui os maiores valores de FC; Além disso, aquele que atribui cargas negativas (-) aos átomos mais eletronegativos.
Se C e D forem mais eletronegativos que A e B, ao compartilhar mais elétrons, eles adquirem cargas formais positivas (vistas de uma regra mnemônica).
Assim, a estrutura mais estável, e a mais favorecida da energia, é C-A-B-D, pois em C e B formam apenas um link. Por outro.
Qual de todas as estruturas é a mais instável? A-C-D-B, porque não apenas C e D formam dois links, mas também suas cargas formais negativas (-) são adjacentes entre si, desestabilizando ainda mais a estrutura.
Exemplos de cálculos de carga formal
BF4- (Íon tetrafluoroborato)
O átomo de boro é cercado por quatro átomos de flúor. Como o B pertence ao Grupo IIIA (13) não possui elétrons compartilhados e forma quatro ligações covalentes, sua FC é (3-4-0 = -1). Em vez disso, para o F, elemento do Grupo VIIa (17), sua CF é (7-6-1 = 0).
Para determinar a carga do íon ou molécula, é suficiente adicionar os CFs individuais dos átomos que o compõem: (1 (-1) + 4 (0) = -1).
No entanto, a FC para B não tem um significado real; Isso é, sobre isso não reside a maior densidade eletrônica. Na verdade, essa densidade eletrônica é distribuída aos quatro átomos F, muito mais elemento eletronegativo do que B.
Pode atendê -lo: ácido fracoBeh2 (hidreto de berílio)
O Beryllium Atom pertence ao Grupo IIA (2), forma dois links e carece, novamente, de elétrons não compartilhados. Assim, o CF para o BE e o H são:
CfSer= 2-2-0 = 0
CfH= 1-1-0 = 0
Beh Load2= 1 (0) + 2 (0) = 0
CO (monóxido de carbono)
Sua estrutura de Lewis pode ser representada como: Ctalo: (embora apresente outras estruturas de ressonância). Repetindo o cálculo da FC, desta vez para o C (do grupo IVA) e o O (do grupo via), você tem:
CfC= 4-3-2 = -1
CfQUALQUER= 6-3-2 = +1
Este é um exemplo em que as cobranças formais não se encaixam na natureza dos elementos. O OR é mais eletronegativo que o C e, portanto, não deve carregar um positivo.
As outras estruturas (c = o e (+Co(-)), embora eles cumpram a alocação coerente das cargas, eles não cumprem a regra do octeto (o C tem menos de oito elétrons de Valencia).
NH4+ (Ion amônio), NH3 e NH2- (Amiduro íon)
Quanto mais elétrons compartilham o n, mais positivo é seu CF (para o íon de amônio, pois não tem disponibilidade de energia para formar cinco ligações).
Aplicando também os cálculos para o n amônio, a amônia e o íon amiduro, depois têm:
Cf = 5-4-0 = +1 (NH4+)
Cf = 5-3-2 = 0 (NH3)
E finalmente:
Cf = 5-2-4 = -1 (NH2-)
Isto é, no NH2- O N tem quatro não compartilhados elétrons e compartilham tudo quando formar o NH4+. Cf para h é igual a 0 e, portanto, seu cálculo é salvo.

