Características da leucina, estrutura, funções, biossíntese
- 1342
- 59
- Conrad Schmidt
O Leucina É um dos 22 aminoácidos que constituem as proteínas dos organismos vivos. Isso pertence a um dos 9 aminoácidos essenciais que não são sintetizados pelo corpo e devem ser consumidos com alimentos ingeridos na dieta.
Leucina foi descrita pela primeira vez em 1818 pelo farmacêutico e químico francês. eu. Proust, que chamou de "caseous de óxido". Mais tarde, Erlenmeyer e Kunlin, o prepararam do ácido α-benzoilamido-β-isopropilacrílico, cuja fórmula molecular é C6H13NO2NO2.
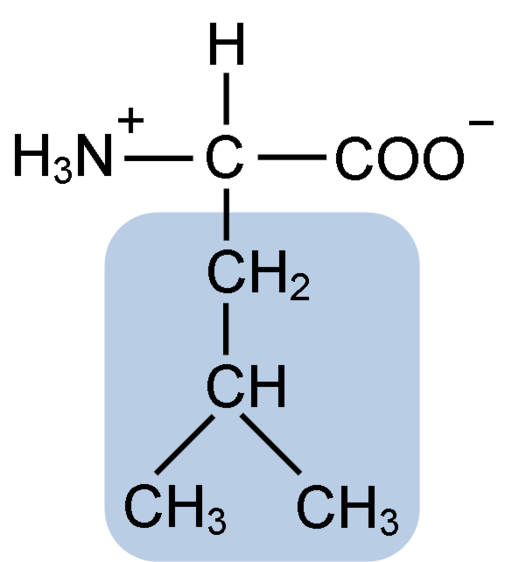
 Estrutura química do aminoácido leucina (funeno: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Estrutura química do aminoácido leucina (funeno: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) A leucina foi fundamental durante a descoberta do senso de tradução de proteínas, uma vez que sua estrutura hidrofóbica permitiu ao bioquímico Howard Dentzis marcar radioativamente o hidrogênio do carbono 3 e observar o significado em que os aminoácidos são incorporados na síntese peptídica da hemoglobina.
As proteínas conhecidas como "zíper" ou "fechamentos" de Leucina são, juntamente com os "dedos de zinco", os fatores de transcrição mais importantes dos organismos eucarióticos. Os zíperes de leucina são caracterizados por suas interações hidrofóbicas com o DNA.
Geralmente, as proteínas ricas em leucina ou constituídas por aminoácidos ramificadas não são metabolizadas no fígado; em vez disso, eles vão diretamente para os músculos onde são usados rapidamente para síntese de proteínas e obtenção de energia.
A leucina é um aminoácido da cadeia ramificada necessária para a biossíntese das proteínas e aminoácidos do leite, que são sintetizados nas glândulas mamárias. Você pode encontrar grandes quantidades desse aminoácido livre dentro do leite materno.
Entre todos os aminoácidos que compõem proteínas, a leucina e a arginina são as mais abundantes e ambas foram detectadas nas proteínas de todos os reinos que compõem a árvore da vida.
[TOC]
Caracteristicas
A leucina é conhecida como o aminoácido essencial da cadeia ramificada, compartilha a estrutura típica com os outros aminoácidos. No entanto, é distinguido porque sua cadeia lateral ou grupo R tem dois carbonos ligados, e o último está ligado a um átomo de hidrogênio e dois grupos metila.
Pertence ao grupo de aminoácidos polares sem carga, os substituintes ou os grupos R desses aminoácidos são natureza hidrofóbica e não polar. Esses aminoácidos são os principais responsáveis por interações hidrofóbicas intra-proto e tendem a estabilizar a estrutura das proteínas.
Todos os aminoácidos, tendo um carbono central quiral (carbono α), ou seja, possui quatro substituintes unidos diferentes, eles podem ser encontrados de duas maneiras diferentes na natureza; Assim, existem D- e L-leucina, o último típico em estruturas de proteínas.
Ambas as formas de cada aminoácido têm propriedades diferentes, participam de diferentes rotas metabólicas e podem até modificar as características das estruturas das quais são parte.
Por exemplo, a leucina na L-leucina tem um sabor ligeiramente amargo, enquanto em sua forma d-leucina é muito doce.
A forma de qualquer aminoácido é mais fácil de metabolizar pelo corpo de mamíferos. A L-Leucina é facilmente degradada e explorada para a construção e proteção de proteínas.
Estrutura
A leucina consiste em 6 átomos de carbono. O carbono central, comum em todos os aminoácidos, está ligado a um grupo carboxil (COOH), um grupo amino (NH2), um átomo de hidrogênio (H) e uma cadeia lateral ou grupo R R composto por 4 átomos de carbono.
Pode servir você: mesothelioÁtomos de carbono dentro de aminoácidos podem ser identificados com letras gregas. A numeração começa com o carbono de ácido carboxílico (COOH), enquanto a anotação com o alfabeto grego começa a partir do carbono central.
A leucina tem como grupo substituinte em sua cadeia r a um grupo isobutil ou 2-metilpropil que é produzido pela perda de um átomo de hidrogênio, com a formação de um radical alquil; Esses grupos aparecem como ramificações na estrutura de aminoácidos.
Funções
A leucina é um aminoácido que pode servir como precursor cetogênico de outros compostos envolvidos no ciclo do ácido cítrico. Este aminoácido representa uma fonte importante para a síntese de acetil-CoA ou acetoacetil-CoA, que fazem parte das rotas de formação dos corpos de cetona em células hepáticas.
Sabe -se que a leucina é indispensável em rotas de sinalização de insulina, que participam do início da síntese de proteínas e evita a perda de proteína devido à degradação.
Geralmente, as estruturas internas das proteínas são compostas de aminoácidos hidrofóbicos, como leucina, valina, isoleucina e métodina. Tais estruturas são geralmente conservadas para enzimas comuns entre os organismos vivos, como no caso do citocromo c.
A leucina pode ativar rotas metabólicas nas células da glândula mamária para estimular a síntese de lactose, lipídios e proteínas que cumprem funções, como moléculas de sinalização na regulação da homeostase energética dos jovens em mamíferos em mamíferos.
Os domínios ricos em leucina são uma parte essencial de proteínas específicas de ligação ao DNA, que geralmente são diâmetros estruturais de uma maneira super inscrita e que são conhecidos como "proteínas com zíper da leucina".
Essas proteínas têm como característica distinta um padrão regular de leucinas repetidas, juntamente com outros aminoácidos hidrofóbicos responsáveis por regular os sindicatos dos fatores de transcrição para o DNA e entre diferentes fatores de transcrição.
As proteínas Zip de leucina podem formar heterodímeros homo-ou.
Biossíntese
Todos os aminoácidos de cadeia ramificados, incluindo a leucina, são sintetizados principalmente em plantas e bactérias. Nas plantas com flores, há um aumento significativo na produção de leucina, pois é um precursor importante para todos os compostos responsáveis pelo aroma de flores e frutas.
Um dos fatores atribuídos à grande abundância de leucina nos diferentes peptídeos bacterianos é que 6 códons diferentes do código genético codificam para leucina (Uua-uug-ucu-cuc-cua-cug), o mesmo também é verdadeiro para arginina.
A leucina é sintetizada em bactérias a partir de uma rota de cinco etapas que usa como ponto de partida um cetácido relacionado à valina.
Esse processo é regulado a partir de alostericamente, de modo que, quando existe um excesso de leucina dentro do celular, inibe as enzimas que participam da rota e interrompem a síntese.
Pode atendê -lo: Simpson Index: Fórmula, Interpretação e ExemploRota biossíntética
A biossíntese de leucina em bactérias começa com a conversão de um cetácido derivado da valina, o 3-metil-2-oxobutanoato em (2s) -2-isopropilmalato, graças à ação da enzima 2-isopropilmalto synta, que usa acetil -Coa e água para esse fim.
O (2s) -2-isopropilmalaato perde uma molécula de água e é transformado em 2-isopropilmaleado por 3-isopropilmalato desidratase. Posteriormente, a mesma enzima adiciona outra molécula de água e transforma o 2-isopropilmaleato em (2R-3s) -3-isopropilm.
O último composto é submetido a uma reação de oxiderdução que merece a participação de uma molécula NAD+, que produz a (2s) -2-isopropil-3-oxossuccinação, o que é possível com a participação da enzima 3- isopropilmalato delubrogenase.
A (2s) -2-ospropil-3-oxossuccinação perde um átomo de carbono na forma de CO2 espontaneamente, gerando o 4-metil-2-oxopentanoato que, por ação de uma transaminase de aminoácidos de cadeia ramificada (transaminase leucina, especificamente) E com a libertação concomitante de L-glutamato e 2-oxoglutarato, produz L-leucina.
Degradação
O principal papel da leucina é atuar como uma sinalização que diz à célula que existem aminoácidos e energia suficientes para iniciar a síntese de proteínas musculares.
A degradação de aminoácidos de cadeia ramificada quando a leucina começa com uma transaminação. Esta e as duas etapas enzimáticas subsequentes são catalisadas pelas três enzimas no caso de leucina, isoleucina e valina.
A transaminação dos três aminoácidos produz os derivados a-cotoacídicos destes, que estão sujeitos a uma descarboxilação oxidativa para produzir tioes de acil-coa que são α, β-di-hidrogenados para executar tioes de acil-CoA α, β-latreados.
Durante o catabolismo da leucina, a correspondente ACIL-CoA descobriu, β-insatura insaturada β (HMG-CoA), que é intermediária na biossíntese de colesterol e outros isoprenoides.
Rota Catabólica de Leucina
A partir da formação do tio acil-coa α, insaturada β, que deriva da leucina as rotas catabólicas deste aminoácido e da valina e da isoleucina divergem consideravelmente.
A leucina isaturada de acil-coa α, insaturada β é processada a jusante por três enzimas diferentes conhecidas como (1) 3-metilcrotonil-coa carboxilase, (2) 3-metilglutaconil-coa hidratosa e (3) 3-hidroxi -3-3-metilglaril -Coa liasa.
Nas bactérias, essas enzimas são responsáveis pela conversão de 3-metilcrotonil-CoA (derivado de leucina) em 3-metilglutaconil-CoA, em 3-hidroxi-3-metilglutaril-CoA e em acetoacetato e acetil-CoA, respectivamente, respectivamente.
A leucina disponível no sangue é explorada para a síntese de proteínas musculares/miofibrilares (MPS). Isso atua como um fator ativador desse processo. Além disso, interaja diretamente com a insulina, influenciando o fornecimento do
Alimentos ricos em leucina
O consumo de proteínas ricas de aminoácidos é indispensável para a fisiologia celular dos organismos vivos e a leucina não é exceção entre os aminoácidos essenciais.
As proteínas obtidas do soro leiteiro são consideradas as mais ricas dos resíduos L-Leucina. No entanto, todos os alimentos com alto teor de proteína, como peixe, frango, ovo e carne vermelha, fornecem grandes quantidades de leucina para o corpo.
Pode atendê -lo: reprodução de vírus: fases e característicasO milho em grãos é ruim nos aminoácidos lisina e triptofano, possui estruturas terciárias muito rígidas para digestão e tem pouco valor do ponto de vista nutricional, no entanto, possui altos níveis de leucina e isoleucina.
Os frutos das plantas de leguminosas são ricos em quase todos os aminoácidos essenciais: lisina, treonina, isoleucina, leucina, fenilalanina e valina, mas têm pouco conteúdo de métodina e cisteína.
A leucina é extraída, purificada e concentrada em comprimidos como suplementos alimentares para atletas de alta concorrência e é comercializada como um medicamento. A principal fonte de isolamento deste aminoácido corresponde às farinhas de soja de soja.
Há um suplemento nutricional usado por atletas para regeneração muscular conhecida como BCAA (inglês "Aminoácido de cadeia ramificada "). Isso fornece altas concentrações de aminoácidos de cadeia ramificada: Leucina, Valina e Isoleucina.
Benefícios da sua ingestão
Alimentos ricos em leucina ajudam a controlar a obesidade e outras doenças metabólicas. Muitos nutricionistas apontam que os alimentos ricos em suplementos de leucina e nutricional com base nesse aminoácido contribuem para a regulação do apetite e ansiedade em adultos.
Todas as proteínas ricas em leucina estimulam a síntese de proteínas musculares; Foi demonstrado que um aumento na proporção de leucina ingerida em relação aos outros aminoácidos essenciais pode reverter a atenuação da síntese de proteínas na musculatura de pacientes idosos.
Mesmo pessoas com distúrbios maculares graves paralisados podem interromper a perda de massa e força muscular com a suplementação correta de leucina oral, além de aplicar exercícios sistêmicos de resistência muscular.
Leucina, valina e isoleucina são componentes essenciais da massa que compõem o músculo esquelético dos animais de vertebrados; portanto, sua presença é vital para a síntese de novas proteínas ou para o reparo do pré -existente.
Distúrbios de deficiência
As deficiências ou malformações do complexo α-zo-gottoat desidrogenase, responsável por metabolizar leucina, valina e isoleucina em humanos, podem causar distúrbios mentais graves.
Além disso, existe uma condição patológica relacionada ao metabolismo desses aminoácidos de cadeia ramificada chamada "Doença da urina com cheiro de xarope de arce".
Até o momento, a existência de efeitos adversos no consumo excessivo de leucina não foi demonstrado. No entanto, recomenda -se uma dose máxima de 550 mg/kg diariamente, pois não houve estudos de longo prazo relacionados à exposição excessiva ao tecido ao referido aminoácido.
Referências
- Álava, m. D. C., Camacho, m. E., & Delgadillo, J. (2012). Saúde muscular e prevenção da sarcopenia: o efeito da proteína, leucina e ß-hidroxi-ß-metilbutirato. Revista de metabolismo ósseo e mineral, 10(2), 98-102.
- FenHeme, OR. R. (1993). Química de alimentos (Não. 664: 543). Apelo.
- Massey, l. K., Sokatch, j. R., & Conrad, R. S. (1976). Catabolismo de amininoácidos de cadeia ramificada em bactérias. Revisões bacteriológicas, 40(1), 42.
- Mathews, c. K., & Ahern, k. G. (2002). Bioquímica. Pearson Education.
- Mera, a. (1999). Suplementação de leucina e treinamento intensivo. Medicina esportiva, 27(6), 347-358.
- Munro, h. N. (Ed.). (2012). Metabolismo da proteína de mamíferos (Vol. 4). Elsevier
- Nelson, d. eu., Lehninger, a. eu., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.

