Isóbaros
- 2683
- 750
- Alfred Kub
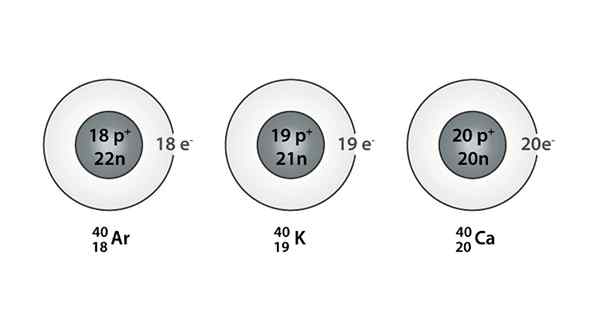
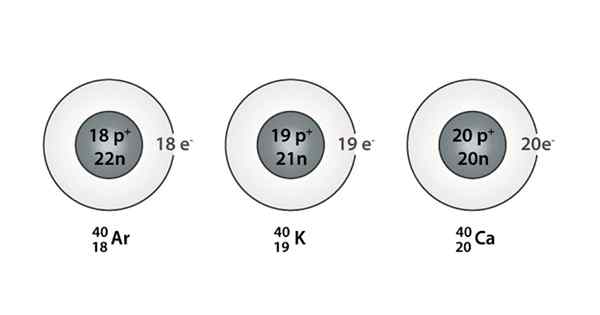 Exemplo de Isóbaro; Argônio, potássio e cálcio, que têm átomos da mesma massa (40)
Exemplo de Isóbaro; Argônio, potássio e cálcio, que têm átomos da mesma massa (40) Quais são os isoparos?
O Isóbaros São aquelas espécies atômicas que têm a mesma massa, mas que vêm de diferentes elementos químicos. Como conseqüência disso, pode -se dizer que eles são constituídos por diferentes números de prótons e nêutrons.
Tanto os prótons quanto os nêutrons estão no núcleo de seus átomos, mas a quantidade líquida de nêutrons e prótons presentes em cada núcleo permanece a mesma. Em outras palavras, uma espécie de Isóbara se origina quando um par de núcleos atômicos mostra o mesmo número líquido de nêutrons e prótons para cada espécie.
No entanto, o número de nêutrons e prótons que constituem que o valor líquido é diferente. Uma maneira de perceber que é observar o número de massa (que é colocado no lado esquerdo superior do símbolo do elemento químico que é representado), porque nas isopias esse número é o mesmo é o mesmo é o mesmo.
A etimologia do termo de Isóbaro vem de palavras gregas ISOs (que significa "o mesmo") e Baros (que significa "peso"), que se refere à igualdade de pesos entre as duas espécies nucleares.
Características dos isoparos
- Os Isoparos mantêm certas semelhanças com outras espécies cujos núcleos presentes apresentam coincidências, como os isótonos, que têm a mesma quantidade de nêutrons, mas com massa diferente e número atômico, como os pares 13C e 14Não 36Areia 37Cl.
- O termo "nucleida" é a denominação que foi cunhada para cada um dos conjuntos de nuclea (estruturas formadas por nêutrons e prótons) que podem ser formados. Para que os nucleids possivelmente se distinguam por seu número de nêutrons ou prótons, ou mesmo pela quantidade de energia que a estrutura de sua conglomeração possui.
Pode servir a você: Liquefação: conceito, gases, solos e sísmicos, seminal- Da mesma forma, existe um núcleo infantil após o β e esse processo, por sua vez, é um isopar do núcleo pai, porque o número de núcleons presentes no núcleo permanece inalterado, diferentemente do que acontece por meio de desintegração α.
- É importante lembrar que os diferentes isóbaros têm um número atômico diferente, confirmando que são elementos químicos diferentes.
Representação
Para denotar os diferentes nucleids, uma notação específica é usada, que pode ser representada de duas maneiras: consiste em colocar o nome do elemento químico seguido por seu número de massa, que são unidos por um script. Por exemplo: Nitrogen-14, cujo núcleo consiste em sete nêutrons e sete prótons.
El otro modo de representar estas especies consiste en colocar el símbolo del elemento químico, precedido por un superíndice numérico que indica el número de masa que posee el átomo en cuestión, así como un subíndice numérico que designa el número atómico del mismo, de la siguiente Maneira:
ZPARAX
Nesta expressão x representa o elemento químico do átomo em questão, a é o número de massa (resultado da adição entre a quantidade de nêutrons e prótons) e z representa o número atômico (igual à quantidade de prótons no núcleo do núcleo de o átomo).
Quando esses nucleids são representados, o número atômico do átomo (z) geralmente é omitido porque não concede dados adicionais relevantes, por isso é frequentemente representado como PARAX.
Uma maneira de mostrar essa notação é dar o exemplo anterior (nitrogen-14), que também é denotado como 14N. Esta é a notação usada para os isoboos.
Pode atendê -lo: propriedades extensas da matériaExemplos de Isóbaros
O uso da expressão "Isóbaros" para espécies conhecidas como nucleids com o mesmo número de núcleons (número de massa igual) foi proposto no final da década de 1910 pelo químico de origem britânica Alfred Walter Stewart.
Nesta ordem de idéias, um exemplo de isoboos pode ser observado no caso de espécies 14C e 14N: o número de massa é igual a 14, isso implica que o número de prótons e nêutrons em ambas as espécies é diferente.
De fato, este átomo de carbono tem um número atômico igual a 6; portanto, em sua estrutura, existem 6 prótons e, por sua vez, possui 8 nêutrons em seu núcleo. Então seu número de massa é 14 (6+8 = 14).
Por sua vez, o átomo de nitrogênio tem um número atômico igual a 7, por isso é composto por 7 prótons, mas possui 7 nêutrons em seu núcleo. Seu número de massa também é 14 (7+7 = 14).
Você também pode encontrar uma série em que todos os átomos têm um número de massa igual a 40; Este é o caso dos Isóbaros: 40AC, 40K, 40Ar, 40Cl, e 40S.
Diferenças entre isoto e isótopos
Os nucleids descrevem os diferentes tipos de núcleos atômicos que existem, de acordo com a quantidade de prótons e nêutrons que eles possuem.
Da mesma forma, entre esses tipos de nucleids estão os isotropos e os isótopos, que serão diferenciados abaixo.
No caso dos Isóbaros, como mencionado anteriormente, eles têm o mesmo número de núcleons -ou seja, o mesmo número de massa -onde o número de prótons pelos quais uma espécie é maior do que a outra concorda com o número de nêutrons que estão em déficit, então o total é o mesmo. No entanto, seu número atômico é diferente.
Pode atendê -lo: soluções cristalóides: composição, tipos e exemplosNesse sentido, as espécies isópicas vêm de diferentes elementos químicos, de modo que estão localizados em diferentes espaços da tabela periódica e têm características diferentes e propriedades específicas.
Por outro lado, no caso dos isótopos, o oposto acontece, pois eles têm o mesmo número atômico, mas massa diferente de massa; Ou seja, eles têm o mesmo número de prótons, mas um número diferente de nêutrons dentro de seus núcleos atômicos.
Além disso, os isótopos são espécies atômicas pertencentes aos mesmos elementos, portanto estão localizados no mesmo espaço na tabela periódica e têm características e propriedades semelhantes.

