Estrutura de hidróxido de mercúrio, propriedades, usos, riscos
- 1560
- 448
- Terrence King IV
Ele Hidróxido de Mercúrio É um composto inorgânico no qual o Mercury Metal (HG) tem um número de oxidação de 2+. Sua fórmula química é Hg (OH)2. No entanto, esta espécie ainda não foi obtida em forma sólida em condições normais.
Mercúrio ou hidróxido de mercúrio O hidróxido. Para estudos realizados em soluções de óxido mercúrico HGO, foi deduzido que Hg (OH)2 É uma base fraca. Outras espécies que o acompanham são HGOH+ e o hg2+.
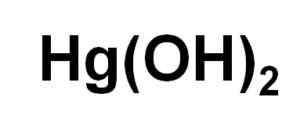 Fórmula química de hidróxido de mercúrio (ii). Autor: Marilú Stea.
Fórmula química de hidróxido de mercúrio (ii). Autor: Marilú Stea. Apesar de não ser capaz de ser precipitado em solução aquosa, o HG (OH)2 Foi obtido por reação fotoquímica de mercúrio com hidrogênio e oxigênio a temperaturas muito baixas. Também foi obtido na forma de um coprecipitado junto com a fé (OH)3, Onde a presença de íons haluro exerce influência no pH no qual ocorre a coprecipitação.
Como não obteve facilmente puro no nível do laboratório, não foi possível encontrar nenhuma utilidade para este composto ou determinar os riscos de seu uso. No entanto, pode -se deduzir que apresenta os mesmos riscos que os outros compostos de mercúrio.
[TOC]
Estrutura da molécula
A estrutura do hidróxido de mercúrio (ii) Hg (OH)2 É baseado em uma porção central linear formada pelo átomo de mercúrio com os dois átomos de oxigênio para os lados.
Os átomos de hidrogênio estão unidos a essa estrutura central, cada um ao lado de cada oxigênio, que gira livremente em torno de cada oxigênio. Pode ser representado de uma maneira simples, conforme indicado abaixo:
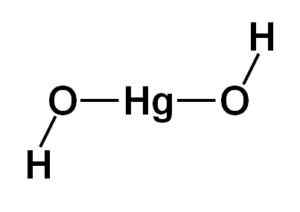 Estrutura teórica do hidróxido de mercúrio (ii). Autor: Marilú Stea
Estrutura teórica do hidróxido de mercúrio (ii). Autor: Marilú Stea Configuração eletronica
A estrutura eletrônica do Mercúrio metálico HG é a seguinte:
[XE] 5d10 6s2
Onde [XE] é a configuração eletrônica do xenônio de gás nobre.
Ao observar essa estrutura eletrônica, é derivado que o estado de oxidação mais estável do mercúrio é aquele em que os 2 elétrons da camada 6 são perdidoss.
Em Hg (OH) Hidróxido Mercurico2, O Mercury Atom (HG) é encontrado em seu estado de oxidação 2+. Portanto, no HG (OH)2 Mercúrio tem a seguinte configuração eletrônica:
Pode atendê -lo: 30 usos de ácidos carboxílicos na vida cotidiana[XE] 5d10
Nomenclatura
- Hidróxido de Mercúrio (II)
- Hidróxido mercúrico
- Di -hidróxido de mercúrio
Propriedades
Peso molecular
236,62 g/mol
Propriedades quimicas
De acordo com as informações consultadas, é possível que Hg (OH)2 Ser um composto transitório na formação de HGO em meio aquoso alcalino.
A adição de íons hidroxila (oh-) para uma solução aquosa com íons mercúrios HG2+ Isso leva à precipitação de um óxido de mercúrio sólido amarelo (ii) HGO, do qual Hg (OH)2 É um passageiro ou agente temporário.
 Óxido de mercúrio (II). LEIEM [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikipedia Commons.
Óxido de mercúrio (II). LEIEM [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikipedia Commons. Em solução aquosa, o HG (OH)2 É um intermediário de vida muito curto, porque libera rapidamente uma molécula de água e precipita o HGO sólido.
Embora não tenha sido possível precipitar o hidróxido mercurico hg (oh)2, O óxido de mercúrio (II) HGO é algo solúvel em água formando uma solução de espécies chamadas "hidróxidos".
Essas espécies na água chamadas "hidróxido" são bases fracas e, embora às vezes se comportem como anfotoradas, em geral o HG (OH)2 É mais básico que o ácido.
Quando o HGO se dissolve no HCLO4 Estudos indicam a presença de íon mercúrico HG2+, Um íon hgoh mono -hidroxiercuro+ e Hg (OH) hidróxido mercúrico2.
Os saldos que ocorrem em soluções tão aquosas são as seguintes:
Hg2+ + H2Ou ⇔ hgoh+ + H+
HGOH+ + H2Ou ⇔ hg (oh)2 + H+
Nas soluções alcalinas Naoh, a espécie Hg (OH) é formada3-.
Obtenção
Hidróxido de mercúrio puro
Hidróxido de Mercúrio (II) HG (OH)2 Não pode ser obtido em solução aquosa, porque ao adicionar álcalis a uma solução de íons comerciais HG2+, precipitar o óxido mercúrico amarelo.
No entanto, alguns pesquisadores conseguiram obter em 2005 pela primeira vez o hidróxido mercurico HG (OH)2 Usando uma lâmpada de arco de mercúrio, a partir do elemento Mercury HG, hidrogênio H2 e oxigênio ou2.
 Lâmpada de Mercúrio. D-Kuru [CC BY-SA 2.0 em (https: // CreativeCommons.Org/licenças/BY-SA/2.0/at/ação.em)]. Fonte: Wikipedia Commons.
Lâmpada de Mercúrio. D-Kuru [CC BY-SA 2.0 em (https: // CreativeCommons.Org/licenças/BY-SA/2.0/at/ação.em)]. Fonte: Wikipedia Commons. A reação é fotoquímica e foi realizada na presença de neon, argônio ou deutério sólido a temperaturas muito baixas (cerca de 5 k = 5 graus Kelvin). As evidências de formação de compostos foram obtidas por espectros de absorção de luz IR (infravermelho).
Pode atendê -lo: precipitarO hg (oh)2 Preparado dessa maneira é muito estável nas condições de experiência. Estima-se que a reação fotoquímica prossegue através do intermediário O-HG-O para a molécula estável H-O-HG-O-H.
Coprecipitação com hidróxido de ferro (III)
Se o Sulfato de Mercúrio (II) HGSO se dissolve4 e sulfato de ferro (iii) fé2(SW4)3 Em solução aquosa ácida, e o pH começa a ser aumentado adicionando uma solução de hidróxido de sódio Naoh, após um tempo de descanso um sólido inferido é formado é um hg co -concipitado (OH)2 e fé (oh)3.
Verificou -se que a formação de HG (OH)2 É uma etapa crítica nesta coprecipitação com fé (oh)3.
A formação de Hg (OH)2 Na fé precipitada (oh)3-HG (OH)2 Depende fortemente da presença de íons como flúor, cloreto ou brometo, da concentração específica destes e do pH da solução.
Na presença de flúor (f-), Um pH maior que 5, a coprecipitação de Hg (OH)2 Com fé (oh)3 não é afetado. Mas para um pH de 4 a formação de complexos entre o HG2+ e f- interfere na coprecipitação de HG (OH)2.
No caso da presença de cloreto (CL-), Coprecipitação de HG (OH)2 Ocorre a um pH de 7 ou mais, ou seja, de preferência em meio alcalino.
Quando o brometo está presente (BR-), Coprecipitação de HG (OH)2 Aparece em pH ainda maior, isto é, pH acima de 8,5, ou mais alcalino do que com cloreto.
Formulários
A partir da revisão das fontes de informação disponíveis, segue -se que o hidróxido de mercúrio (ii) Hg (OH)2, Sendo um composto ainda não preparado comercialmente, não tem usos conhecidos.
Estudos recentes
Através de técnicas de simulação computacional em 2013, as características estruturais e energéticas relacionadas à hidratação HG (OH) foram estudadas2 Em um estado gasoso.
As energias de coordenação e solvatação de metal-ligando foram calculadas e comparadas variando o grau de hidratação HG (OH)2.
Entre outras coisas, verificou -se que aparentemente o estado de oxidação teórico é 1+ em vez do suposto 2+ geralmente atribuído para Hg (OH)2.
Pode atendê -lo: desempenho teóricoRiscos
Embora o HG (OH)2 Como tal, não foi isolado em quantes suficientes.
Pode ser tóxico para o sistema nervoso, sistema digestivo, pele, olhos, sistema respiratório e rins.
A inalação, ingestão ou contato com a pele dos compostos de mercúrio pode causar danos que variam da irritação de olhos e pele, insônia, dores de cabeça, tremores, danos ao trato intestinal, perda de memória, insuficiência renal, entre outros sintomas.
Mercúrio foi reconhecido internacionalmente como poluente. A maioria dos compostos de mercúrio que entra em contato com o meio ambiente é metilada pelas bactérias presentes em solos e sedimentos, formando metilmercúrio.
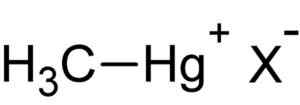 Metilmercúrio Hal. Autor: Carregado pelo usuário: Rifleman 82. Fonte: Desconhecido. Fonte: Wikipedia Commons.
Metilmercúrio Hal. Autor: Carregado pelo usuário: Rifleman 82. Fonte: Desconhecido. Fonte: Wikipedia Commons. Este composto é bioacumula em organismos vivos, passando do chão para as plantas e de lá para os animais. No ambiente aquático, a transferência é ainda mais rápida, passando de espécies muito pequenas para as grandes em pouco tempo.
O metilmercúrio tem um efeito tóxico para seres vivos e, em particular, para o ser humano, que o ingere através da cadeia alimentar.
Quando ingerido com comida é especialmente prejudicial para crianças e fetos pequenos em mulheres grávidas, pois ser neurotoxina pode causar danos cerebrais e sistema nervoso em formação e crescimento.
Referências
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Wang, Xuefeng e Andrews, Lester (2005). Espectro infravermelho de HG (OH)2 em neon sólido e argônio. Química Inorgânica, 2005, 44, 108-113. Recuperado de bares.ACS.org.
- Amaro-Estrada, J.Yo., et al. (2013). Solvatação aquosa de HG (OH)2: Estudos de teoria funcional de densidade enérgica e dinâmica do HG (OH)2-(H2QUALQUER)n (N = 1-24) estruturas. J. Phys. Chem. Para 2013, 117, 9069-9075. Recuperado de bares.ACS.org.
- Inoue, Yoshikazu e Munemori, Makoto. (1979). Coprecipitação de mercúrio (ii) com hidróxido de ferro (iii). Ciência e Tecnologia Ambiental. Volume 13, número 4, abril de 1979. Recuperado de bares.ACS.org.
- Chang, l.C., et al. (2010). Sistema nervoso e toxicologia comportamental. Na compreensão da toxicologia. Recuperado de cientedirect.com.
- Haney, Alan e Lipsey, Richard L. (1973). Acumulação e efeitos do hidróxido de metil mercúrio em uma cadeia alimentar terrestre sob condiões de laboratório. Ambiente. Poluente. (5) (1973) pp. 305-316. Recuperado de cientedirect.com.
- « Flavin Adenin Dinucleotide (FAD) Características, Biossíntese
- Estrutura de 3-fosfato gliceraldeído (G3P), funções »

