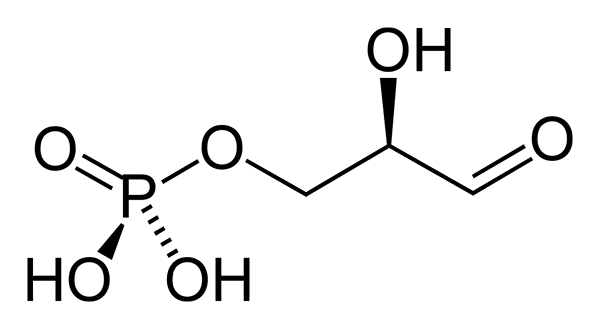
Estrutura de 3-fosfato gliceraldeído (G3P), funções
- 762
- 36
- Alfred Kub
Ele gliceraldeído 3-fosfato (gap) É um metabólito da glicólise (seu nome vem do grego; glicos = doce ou açúcar; lise = ruptura), que é uma via metabólica que converte a molécula de glicose em duas moléculas de piruvato para produzir energia na forma de adenosina tryfosfato (ATP ).
Nas células, o gliceraldeído 3-fosfato conecta a glicólise com a gliconeogênese e o caminho de fosfato de pentose. Em organismos fotossintéticos, o gliceraldeído 3-fosfato, da fixação de dióxido de carbono, é usado para biossíntese de açúcar. No fígado, o metabolismo da frutose produz gap, que é incorporado à glicólise.
 Fonte: Benjah-BMM27 [Domínio Público]
Fonte: Benjah-BMM27 [Domínio Público] [TOC]
Estrutura
O gliceraldeído 3-fosfato é um açúcar fosforilado que tem três carbonos. Sua fórmula empírica é c3H7QUALQUER6P. O grupo aldeído (-CHO) é carbono 1 (C-1), o grupo hidroximetileno (-Chah) é carbono 2 (C-2) e o grupo hidroximetil (-CH2OH) é carbono 3 (C3). Este último forma um link com o grupo fosfato (Link Fosfoester).
A configuração de 3-fosfato gliceraldeído no quiral C-2 é D. Por convenção, em relação ao carbono quiral, na projeção de Fischer, o grupo aldeído é representado para cima, o grupo hidroximetil-fosfato baixo, o grupo hidroxil à direita e o átomo de hidrogênio à esquerda.
Caracteristicas
O gliceraldeído de 3-fosfato tem uma massa molecular 170,06 g/mol. A mudança de energia livre de Gibbs padrão (ΔGº) para qualquer reação deve ser calculada adicionando a variação da energia livre dos produtos e subtraindo a soma da variação da energia livre dos reagentes.
Pode atendê -lo: metazoa: características, tipos, habitat e doençasDessa maneira, a variação de energia livre (ΔGº) é determinada por gliceraldeído 3 -fosfato, que é -1.285 kJ × mol-1. Por convenção, no estado padrão 25 ºC e 1 atm, a energia livre dos elementos puros é zero.
Funções
Glicólise e gliconeogênese
A glicólise está presente em todas as células. É dividido em duas fases: 1) estágio de investimento energético e síntese de metabólitos com alto potencial de transferência do grupo de fosfato, como o gliceraldeído 3-fosfato (gap); 2) estágio de síntese de ATP de moléculas com alto potencial de transferência para grupo de fosfato.
O fosfato de 3-fosfato gliceraldeído e di-hidroxiacetona. O gliceraldeído 3-fosfato é transformado em 1,3-bifosfoglicerado (1,3bpg), por meio de uma reação catalisada pela enzima lacuna desidrogenase.
A lacuna de desidrogenase catalisa a oxidação do átomo de carbono de aldeído e transfere um grupo de fosfato. Assim, é formado um anidrido misto (1,3bpg) no qual o grupo ácido e o átomo de fósforo são propensos à reação de ataque nucleofílico.
Então, em uma reação catalisada pela 3-fosfoglicerado quinase, o 1,3bpg transfere o grupo fosfato do carbono 1 para o ADP, formando ATP.
Como as reações catalisadas pela aldolase, o hiato da desidrogenase e a 3-fosfogliceridade quinase estão no equilíbrio (ΔGº ~ 0), são reversíveis, portanto, parte do caminho da gluconeogênese (ou da nova síntese de glicose).
Vía de la pentosa fosfato e ciclo de Calvin
Na estrada de fosfato de pentose, o gliceraldeído de 3-fosfato (gap) e a frutose de 6-fosfato (F6p) são formados por reações de corte e formação de ligações C-C, a partir da pentose, xilulose 5-fosfato e ribose 5-fosfato.
Pode servir a você: Hyracotherium: características, nutrição, espécie, reproduçãoO gliceraldeído de 3-fosfato pode seguir o caminho da gliconeogênese e formar glicose de 6-fosfato, que continua o caminho do fosfato de pentose. A glicose pode ser completamente oxidada produzindo seis co -moléculas2 Através do estágio oxidativo da estrada de fosfato de Pontosa.
No ciclo Calvin, o CO2 É definido como 3-fosfoglicerado, em uma reação catalisada pela ribulosa bifosfato carboxilase. Então, 3-fosfoglicerato é reduzido pelo NADH por ação de uma enzima chamada gap desidrogenase.
2 moléculas de gap para biossíntese de uma hexose, como a glicose, que serve para biossíntese de amido ou celulose em plantas em plantas são necessárias.
Metabolismo da frutose
A enzima frutocinase catalisa a fosforilação da frutose pelo ATP em C-1, formando 1-fosfato frutose. A aldolase A, encontrada no músculo, é específica para frutose 1.6-bifosfato como substrato. A aldolase B é encontrada no fígado e é específica de 1-fosfato frutose como substrato.
A B-Aldolase catalisa a ruptura aldólica de frutose 1-fosfato e produz fosfato de di-hidroxiacetona e gliceraldeia. O gliceraldeído quinase catalisa a fosforilação do gliceraldeído através do ATP, formando um intermediário glicolítico, o 3-fosfato gliceraldeído (gap).
Em uma rota diferente, o gliceraldeído é transformado em glicerol por uma desidrogenase de álcool que NADH usa como substrato de doador de elétrons. Então, glicerol fosforilato quinase glicerol por ATP, formando fosfato de glicerol. Este último metabólito é a reoxi, formando fosfato de di -hidroxiacetona (DHAP) e NADH.
O DHAP é convertido em lacuna pela enzima fosfato de três isomease. Dessa maneira, a frutose é convertida em metabólitos de glicólise. No entanto, a frutose fornecida por via intravenosa pode causar danos graves, que consistem na diminuição drástica do fosfato intracelular e ATP. Mesmo a acidose lática ocorre.
Pode servir você: Chihuahua Flora e Fauna: Espécies excelentesO dano à frutose é devido ao fato de não ter os pontos de regulamentação que o catabolismo de glicose normalmente tem. Primeiro, a frutose entra nos músculos através do GLUT5, que é independente da insulina.
Segundo, a frutose é diretamente convertida em lacuna e, dessa maneira, não passa pela regulação da enzima fosfofuto quinase (PFK) no início da glicólise.
Via Entner-Doudoroff
A glicólise é a rota universal para o catabolismo da glicose. No entanto, algumas bactérias usam alternadamente a estrada de Entner-Doudoroff. Esta rota implica seis etapas catalisadas por enzimas, nas quais a glicose é transformada em Gap e Pyruvato, que são dois produtos finais desta estrada.
Gap e piruvato são transformados em etanol por reações de fermentação alcoólica.
Referências
- Berg, j. M., Tymoczco, j. eu., Stryer, l. 2015. Bioquímica. Para curto. C. H. Freeman, Nova York.
- Miesfeld, r. eu., McEvoy, m. M. 2017. Bioquímica. C. C. Norton, Nova York.
- Nelson, d. eu., Cox, m. M. 2017. Lehninger Principles of Biochemistry. C. H. Freeman, Nova York.
- Saway j. G. 2004. Metabolismo em um olhar. Blackwell, Malden.
- Voet, d., Voet, J. G., Pratt, c. C. 2008. Fundamentos da bioquímica: vida no nível molecular. Wiley, Hoboken.
- « Estrutura de hidróxido de mercúrio, propriedades, usos, riscos
- Características tráveis e formação de camadas »

