Hidróxido de cálcio (CA (OH) 2) Estrutura, propriedades, obtenção, usos

- 1510
- 398
- Mr. Reginald Lindgren
Ele hidróxido de cálcio É um composto inorgânico cuja fórmula química é CA (OH)2. É um pó branco que tem sido usado há milhares de anos, durante todo o qual ganhou vários nomes ou apelidos tradicionais; Entre eles, podemos mencionar o maçante, morto, químico, hidratado ou fino.
Na natureza, está disponível em um mineral pouco abundante chamado Portlandita, da mesma cor. Por causa disso, o CA (OH)2 Não é obtido diretamente deste mineral, mas de um tratamento térmico, seguido de hidratação, de calcário. Isso é obtido por limão, Cao, que posteriormente desliga ou hidrata para produzir o CA (OH)2.
 Uma amostra sólida de hidróxido de cálcio. Fonte: Chemicalintest [Domínio Público]
Uma amostra sólida de hidróxido de cálcio. Fonte: Chemicalintest [Domínio Público] O CA (OH)2 É uma base relativamente fraca na água, pois mal consegue se dissolver em água quente; Mas sua solubilidade aumenta em água fria, porque sua hidratação é exotérmica. No entanto, sua basicidade continua sendo um motivo para ter cuidado com ela durante sua manipulação, pois pode causar queimaduras em qualquer lugar do corpo.
Foi usado como um regulador de pH para diferentes materiais ou alimentos, além de ser uma boa fonte de cálcio em relação à sua massa. Possui aplicações na indústria de papel, na desinfecção do esgoto, em produtos depilantes, em mantimentos feitos de farinha de milho.
No entanto, seu uso mais importante tem sido como material de construção, pois a cal é hidratada ao misturar com os outros ingredientes do gesso ou argamassa. Nessas misturas endurecidas, CA (OH)2 Absorver o dióxido de carbono do ar para consolidar os cristais de areia junto com o carbonato de cálcio formado.
Atualmente, a pesquisa ainda é realizada com o objetivo de desenvolver melhores materiais de construção que tenham CA (OH)2 diretamente em sua composição como nanopartículas.
[TOC]
Estrutura
Cristal e seus íons
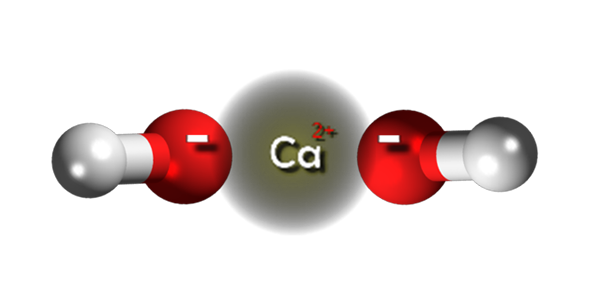 Íons hidróxido de cálcio. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Íons hidróxido de cálcio. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Na imagem superior, temos os íons que integram o hidróxido de cálcio. É a mesma fórmula CA (OH)2 aponta isso para cada cátion CA2+ Existem dois ânions oh- que interagem com ele por atração eletrostática. O resultado é que ambos os íons acabam estabelecendo um cristal de estrutura hexagonal.
Em tais cristais hexagonais de CA (OH)2 Os íons estão muito próximos um do outro, o que dá a aparência de ser uma estrutura polimérica; Embora não haja formalmente uma ligação covalente, ca-o, dada a notável diferença de eletronegatividade entre os dois elementos.
 Estrutura de hidróxido de cálcio
Estrutura de hidróxido de cálcio A estrutura gera octadros cao6, isto é, o CA2+ interagir com seis oh- (AC2+-Oh-).
Pode atendê -lo: hidróxido de lítio (lioh)Uma série desses octaedros compõe uma camada de vidro, que pode interagir com outra por pontes de hidrogênio que as mantêm intermolecularmente coesas; No entanto, essa interação desaparece a uma temperatura de 580 ºC, quando o CA (OH) está desidratado2 para cao.
No lado das altas pressões, não há muita informação sobre isso, embora os estudos tenham verificado que, a uma pressão de 6 GPa, o vidro hexagonal sofre uma transição da fase hexagonal para a monoclínica; E com isso, a deformação dos octadros Cao6 e suas camadas.
Morfologia
Os cristais CA (OH)2 Eles são hexagonais, mas isso não é um impedimento para eles adotarem qualquer morfologia. Algumas dessas estruturas (fios, flocos ou rochas) são mais porosas que outras, robustas ou planas, o que influencia diretamente suas aplicações finais.
Assim, não é o mesmo usar cristais do mineral de Portland, do que para sintetizá -los para que eles consistam em nanopartículas onde alguns parâmetros rigorosos são seguidos; como o grau de hidratação, a concentração do CAO usada e o tempo permitido cultivar vidro.
Propriedades
Aparência física
Branco sólido, banheiro e sabor amargo sólido.
Massa molar
74.093 g/mol
Ponto de fusão
580 ºC. Nesta temperatura, ele quebra a liberação de água, para que nunca chegue a vaporizar:
CA (OH)2 => Cao + H2QUALQUER
Densidade
2.211 g/cm3
ph
Uma solução aquosa aquosa tem um pH de 12,4 a 25 ºC.
Solubilidade em água
A solubilidade de CA (OH)2 Na água diminui com um aumento de temperatura. Por exemplo, a 0 ºC, sua solubilidade é de 1,89 g/L; enquanto em 20 ºC e 100 ºC, estes são 1,73 g/L e 0,66 g/L, respectivamente.
Isso indica um fato termodinâmico: hidratação da CA (OH)2 É exotérmico, obedecendo ao princípio de Le Catelier, a equação seria:
CA (OH)2 AC2+ + 2oh- + Q
Onde está o calor liberado. Quanto mais quente a água, o equilíbrio tenderá mais à esquerda; isto é, o CA (OH) vai se dissolver menos2. É por esse motivo que em água fria se dissolve muito mais do que em água fervente.
Por outro lado, essa solubilidade aumenta se o pH se tornar ácido, devido à neutralização de íons OH- e para o deslocamento do saldo anterior para a direita. Durante esse processo, ainda mais calor é liberado do que em água neutra. Além das soluções aquosas ácidas, CA (OH)2 Também é solúvel em glicerol.
K$
5.5 · 10-6. Este valor é considerado pequeno e concorda com a baixa solubilidade de CA (OH)2 Na água (o mesmo equilíbrio acima).
Pode atendê -lo: metaisÍndice de refração
1.574
Estabilidade
O CA (OH)2 Permanece estável, desde que não esteja exposto a CO2 do ar, uma vez que o absorve e forma carbonato de cálcio, caco3. Portanto, começa a ser impurificado em uma mistura sólida de cristais de CA (OH)2-Ladrão3, Onde existem co -anions32- competindo com oh- Para interagir com CA2+:
CA (OH)2 + Co2 => Caco3 + H2QUALQUER
De fato, esta é a razão pela qual as soluções concentradas de CA (OH)2 Eles giram camas, como uma suspensão de partículas de caco aparece3.
Obtenção
O CA (OH)2 É obtido comercialmente reagindo o cal, CAO, com um excesso de duas a três vezes de água:
Cao + h2O => CA (OH)2
No entanto, a carbonização de CA (OH) pode ocorrer no processo2, Assim como explicado acima.
Outros métodos para obtê -lo consistem em usar sais solúveis de cálcio, como o clique2 ou CA (não3)2, e baseá -los com Naoh, para que o CA (oh) apressado2. Controlar os parâmetros como volumes de água, temperatura, pH, solvente, grau de carbonização, tempo de maturação, etc., Nanopartículas com diferentes morfologias podem ser sintetizadas.
Também pode ser preparado selecionando matéria -prima natural e renovável ou o desperdício de uma indústria, rico em cálcio, que quando suas cinzas são aquecidas e processadas, consistirão em cal; E a partir daqui, novamente, CA (OH) pode ser preparado2 Hidratando essas cinzas sem a necessidade de desperdiçar calcário, caco3.
Por exemplo, o Bantazo del Agave foi usado para esse fim, atribuindo um valor agregado ao desperdício das indústrias de tequila.
Formulários
Tratamento alimentar
 Os picles são encharcados em hidróxido de cálcio para ser mais crocante. Fonte: Pixabay.
Os picles são encharcados em hidróxido de cálcio para ser mais crocante. Fonte: Pixabay. O hidróxido de cálcio está presente em muitos alimentos em alguns de seus estágios de preparação. Por exemplo, em uma solução aquosa, os picles estão imersos, como pepinos, para torná -los mais crocantes ao empacotá -los em vinagre. Isso ocorre porque as proteínas de sua superfície absorvem cálcio no meio.
Da mesma forma, ocorre com grãos de milho antes de transformá -los em farinha, porque ajuda a liberar vitamina B3 (Niacina) e facilita sua moagem. O cálcio que ele fornece também é usado para adicionar valor nutricional a certos sucos.
O CA (OH)2 Você também pode substituir o fermento em algumas receitas de pão e esclarecer as soluções de cana -de -açúcar de cana e beterraba.
Desinfetante de esgoto
Ação clarificadora de CA (OH)2 É porque atua como um agente floculante; isto é, o tamanho das partículas suspensas aumenta para formar floccúlus, que posteriormente sedimentam ou podem filtrar.
Pode atendê -lo: Pauling ScaleEsta propriedade foi usada para desinfetar o esgoto, desestabilizando seus colóides desagradáveis em vista (e cheiro) dos espectadores.
Indústria de papel
O CA (OH)2 É usado no processo Kraft para regenerar o NaOH usado para tratar a madeira.
Absorvente a gás
O CA (OH)2 É usado para eliminar o CO2 de espaços fechados ou em ambientes onde sua presença é contraproducente.
Cuidado pessoal
Nas formulações para cremes depilatórios, o CA (OH)2 É tacitamente, porque sua basicidade ajuda no enfraquecimento da queratina dos cabelos e, portanto, é mais fácil removê -los.
Obras de construção
 O hidróxido de cálcio faz parte das estruturas de obras antigas, como as pirâmides do Egito. Fonte: pexels.
O hidróxido de cálcio faz parte das estruturas de obras antigas, como as pirâmides do Egito. Fonte: pexels. O CA (OH)2 Ele está presente desde tempos imemoriais, integrando as massas de gesso e argamassa usadas na construção de obras arquitetônicas egípcias, como pirâmides; Também edifícios, mausoléus, paredes, escadas, pisos, suportes e até para reconstruir o cimento dental.
Sua ação fortificadora é devido ao fato de que, "respirando" o CO2, Os cristais resultantes de caco3 As areias e outros componentes de tais misturas acabam em melhor grau.
Riscos e efeitos colaterais
O CA (OH)2 Não é um sólido fortemente básico em comparação com outros hidróxidos, embora mais que o MG (OH)2. Mesmo assim, apesar de não ser reativo ou inflamável, sua basicidade ainda é agressiva o suficiente para causar pequenas queimaduras.
Portanto, deve ser manipulado com respeito, porque é capaz de irritar os olhos, a língua e os pulmões, além de desencadear outros males, como: perda de visão, alcalinização grave do sangue, erupções cutâneas, vômitos e dor na garganta.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Cálcio hidróxido. Recuperado de: em.Wikipedia.org
- Chávez Guerrero et al. (2016). Síntese e caracterização do hidróxido de cálcio obtido da agave bagaço e pesquisa de sua atividade antibacteriana. Recuperado de: Scielo.org.mx
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Estrutura cristalina da fase de alta pressão de hidróxido de cálcio, portlandita: em pó situado e estudo de diffração de raios-X de cristal único. Mineralogista americano; 98 (8-9): 1421-1428. Doi: doi.org/10.2138/AM.2013.4386
- Hans Lohninger. (5 de junho de 2019). Cálcio hidróxido. Química Librettexts. Recuperado de: química.Librettexts.org
- Aniruddha s. et al. (2015). Síntese de hidróxido de nano cálcio em meio de aflição. A Sociedade Cerâmica Americana. doi.org/10.1111/Jace.14023
- Carly Vandergrindt. (12 de abril de 2018). Como o hidróxido de cálcio é usado em alimentos e é seguro? Recuperado de: Healthline.com
- Brian Clegg. (26 de maio de 2015). Cálcio hidróxido. Recuperado de: químicaworld.com
- « Características e exemplos de fenômenos químicos
- Características de Mesohypus, Espécies, Reprodução, Nutrição »

