Estruturas de hexoquinase, funções, formas
- 5046
- 982
- Shawn Leffler
O Hexoquinase (HK) é a enzima que catalisa a primeira reação da rota glicolítica virtualmente em todos os organismos vivos, tanto em procariontes quanto em eucariotos. É responsável pela transferência de um grupo fosforil para a glicose, produzindo glicose-6p, embora também possa fosforilar outros açúcares hexáticos (de 6 átomos de carbono).
Essa enzima é classificada em uma das duas famílias de enzimas glicose -quinase (enzimas que transferem grupos fosforil para substratos como glicose): a família da hexoquinase (HK), cujos membros são subdivididos em três grupos diferentes conhecidos como grupo HK, o grupo, o grupo HK, o grupo HK, o Grupo A e Grupo B.
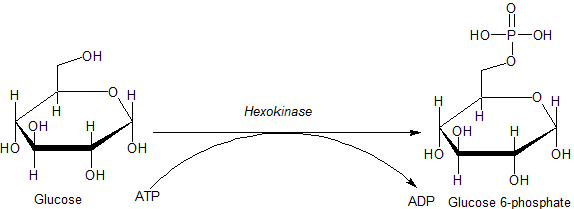
 Reação catalisada pela enzima hexoquinase (fonte: jmun7616 [domínio público] via Wikimedia Commons)
Reação catalisada pela enzima hexoquinase (fonte: jmun7616 [domínio público] via Wikimedia Commons) As enzimas pertencentes à família HK são caracterizadas pela fosforilação da glicose às custas do ATP como uma molécula do doador de grupo fosforil, e os membros da mesma diferem um do outro principalmente em relação ao seu peso molecular e especificidade do substrato.
The HK Group belongs the enzymes of eukaryotic organisms (ATP: D-hexose 6-fosfotransferases), meanwhile group A is represented by the enzymes of the gram-negative bacteria, cyanobacteria, amithocondried and tripanosomatidal protists, and group B contains the enzymes of gram -Bactérias positivas e organismos de Creanarqueotas.
As enzimas dos grupos A e B também são conhecidas como glicoquinases (GLCKs), pois são capazes de fosforilação exclusivamente de glicose, razão pela qual essas enzimas são chamadas ATP: D-Glucose 6-Fosfotransferase.
Como a enzima glicolítica, a hexocinase tem grande importância metabólica, porque sem ela essa rota importante não seria possível e as células altamente dependentes do consumo de carboidratos, como, por exemplo, as células cerebrais e musculares de muitos mamíferos, teriam graves impedimentos funcionais e fisiológicos em geral.
[TOC]
Estrutura
Como será visto mais tarde, em mamíferos e outros vertebrados (bem como em organismos unicelulares, como leveduras), existem diferentes tipos de enzimas hexoquinase. Nos mamíferos, quatro foram descritos: isoformas i, ii, iii e iv.
Pode servir a você: ligas ferrosas: características, tipos, exemplosAs três primeiras isoenzimas têm 100 kDa de peso molecular, mas a isoenzima IV tem 50 kDa. Essas isoenzimas (especialmente I-III) exibem alta similaridade de sequência entre elas em relação aos seus fins C- e N-terminais, bem como a outros membros da família hexoquinase.
O domínio N-terminal dessas enzimas é considerado o domínio "regulador", enquanto a atividade catalítica é realizada pelo domínio C-terminal (HK II de mamíferos possui locais ativos em ambos os domínios).
O domínio N-terminal está ligado ao domínio C-terminal através de uma hélice alfa, cada um tem cerca de 50 kDa de peso molecular e tem uma junção para glicose.
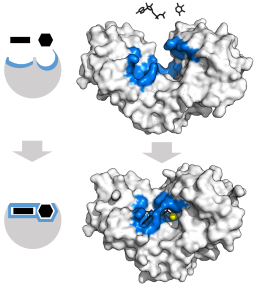 Modelo de ajuste induzido para a enzima hexoquinase (com relação aos dois substratos: o ATP e a glicose) (fonte: Thomas Shafee [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)] via Wikimedia Commons)
Modelo de ajuste induzido para a enzima hexoquinase (com relação aos dois substratos: o ATP e a glicose) (fonte: Thomas Shafee [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)] via Wikimedia Commons) A estrutura terciária dessas enzimas é essencialmente composta de folhas de placas β misturadas com hélices alfa, cuja proporção varia em relação à enzima e às espécies em questão; O local da União para o ATP, o outro substrato da hexoquinase, é geralmente composto por cinco folhas β e duas hélices alfa.
Funções
A hexoquinase tem uma função transcendental no metabolismo de carboidratos da maioria dos seres vivos, uma vez que catalisa o primeiro passo da rota glicolítica, mediando a fosforilação da glicose dentro.
Esta primeira etapa da glicólise, que consiste na transferência de um grupo fosforil do ATP (doador) para a glicose, dando 6-fosfato e da glicose ADP, é a primeira das duas etapas de investimento em energia na forma de ATP.
Além disso, a reação catalisada pela hexoquinase é a passagem de "ativação" da glicose para o processamento subsequente e representa um passo de "compromisso", uma vez que a glicose assim a fosforilada não pode deixar a célula através de seus transportadores convencionais no plasma da membrana.
Pode atendê -lo: misturas heterogêneasO produto da reação catalisado pela hexoquinase, ou seja, a glicose de 6-fosfato, é um ponto de ramo, pois é o primeiro substrato usado na rota do fosfato de pentose e na síntese de glicogênio em muitos animais (e de de o amido nas plantas).
Em plantas
A função da hexoquinase nas plantas não é muito diferente da dos animais ou microorganismos, no entanto, nas plantas superiores, essa enzima também funciona como um "sensor" da concentração de açúcar.
A importância dessa função nesses organismos tem a ver com a participação de açúcares como fatores de regulação na expressão de genes envolvidos em diferentes processos metabólicos, como:
- Fotossíntese
- O ciclo de glioxilato
- A respiração
- A degradação ou síntese de amido e sacarose
- Metabolismo de nitrogênio
- A defesa contra patógenos
- Regulação do ciclo celular
- A resposta de cura
- Pymentation
- Senescência, entre outros.
Esta função da hexoquinase como um "sensor" da quantidade de glicose intracelular também foi descrita para leveduras e mamíferos.
Formas
Na natureza, existem diferentes formas de hexoquinases e isso depende fundamentalmente das espécies que são consideradas.
No homem e em outros animais de vertebrados, por exemplo, a existência de 4 isoformas diferentes da enzima hexoquinase no compartimento citosólico foi demonstrado, ao qual foi indicado com os números romanos I, II, III e IV.
As isoenzimas, II e III são de 100 kDa de peso molecular, são inibidas pelo seu produto de reação (glicose de 6-fosfato) e estão muito relacionadas à glicose, ou seja, elas têm uma constante de Km muito baixa. No entanto, essas enzimas têm pouca especificidade de substrato, sendo capaz de fosforilar outras hexosas, como frutose e mão.
Pode atendê -lo: ácidos: características e exemplosA isoenzima IV, também conhecida como glicoquinase (GLCK), possui apenas 50 kDa de peso molecular e, apesar de estar pouco relacionado (altos valores de km), tem uma alta especificidade por glicose como substrato e não está sujeita a eles mecanismos de regulação que o outro Três isoenzimas.
A glucoquinase (isoenzima IV da hexoquinase de muitos mamíferos) é encontrada principalmente no fígado e ajuda esse órgão no "ajuste" de sua velocidade de consumo de glicose em resposta às variações desse substrato no sangue circulante.
Os três genes que codificar.
Referências
- Aronoff, s. eu., Berkowitz, k., Shreiner, b., E quero, eu. (2004). Metabolismo e regulação da glicose: além da insulina e glucagon. Diabetes de espectro, 17(3), 183-190.
- Harrington, g. N., & BUSH, D. R. (2003). O papel bifuncional da hexoquinase no metabolismo e na sinalização da glicose. A célula da planta, quinze(11), 2493-2496.
- Jang, J. C., León, p., Zhou, l., & Sheen, J. (1997). Hexoquinase quanto ao sensor de açúcar em plantas superiores. A célula da planta, 9(1), 5-19.
- Kawai, s., Mukai, t., Mori, s., Mikami, b., & Murata, K. (2005). Hipótese: estruturas, evolução e ancestral de glicose quinases na família hexoquinase. Jornal de Biociência e Bioengenharia, 99(4), 320-330.
- Mathews, k. E. (1998). Van Holde. Bioquímica.
- Wilson, J. E. (2003). Isozimas da hexoquinase de mamíferos: estrutura, localização subcelular e função metabólica. Jornal de Biologia Experimental, 206(12), 2049-2057.

