Grupo hidroxila

- 2613
- 502
- Mr. Reginald Lindgren
Explicamos o que um grupo hidroxila, suas características, estrutura e vários exemplos é
 Estrutura química do grupo hidroxila
Estrutura química do grupo hidroxila O que é um grupo hidroxila?
A Grupo hidroxila É um grupo funcional ou parte de outros grupos funcionais presentes em muitos compostos orgânicos e inorgânicos. É formado por um átomo de hidrogênio e um de oxigênio (daí o seu nome).
Os grupos hidroxila geralmente estão ligados a um átomo de carbono ou outro elemento não -metálico, como enxofre ou fósforo, entre outros, e são um dos grupos funcionais mais importantes da química orgânica.
Esse grupo de átomos está presente em grupos funcionais orgânicos, como álcoois, fenóis e ácidos carboxílicos, e é o que dá a cada um desses grupos funcionais suas propriedades químicas características características características características. Em diferentes estruturas, pode ser representado como -oh ou ho-
Características dos grupos hidroxila
- Consiste em um átomo de oxigênio e um de hidrogênio ligado um ao outro e ligado a outro átomo em uma molécula através de ligações covalentes.
- A ligação entre o hidrogênio e o átomo de oxigênio é uma ligação polar na qual o oxigênio tem uma carga parcial negativa e hidrogênio parcial positivo, o que faz do grupo hidroxila um grupo funcional polar.
- Tem uma estrutura semelhante à da água. Por esse motivo, muitos dos compostos que o contêm geralmente são solúveis no referido solvente.
- Possui um hidrogênio diretamente ligado ao átomo de oxigênio, para que o grupo hidroxila possa formar uma ligação de hidrogênio na qual participa como um grupo de hidrogênio doador.
- Tendo dois elétrons livres no átomo de oxigênio, o grupo hidroxila pode formar duas ligações de hidrogênio adicionais que atuam como aceitador de átomos de hidrogênio.
- Você pode agir como um ácido, dando um próton a uma base. Dependendo do grupo funcional do qual é parte e do átomo ao qual está diretamente ligado, o grupo hidroxila pode mostrar diferentes níveis de acidez. Por exemplo, em álcoois, possui um PKA de 15 ou mais (ácido feroz que a água), em fenóis varia entre 7 e 10, enquanto em ácidos carboxílicos é geralmente entre 4 e 5.
- Você também pode atuar como uma base de Lewis, doando um de seus pares de elétrons para vincular a outro próton ou algum outro ácido de Lewis.
Estrutura do grupo hidroxila
Como mencionado entre as características, oxigênio e átomos de hidrogênio no grupo hidroxila formam uma ligação covalente polar.
Além disso, o átomo de oxigênio forma uma segunda ligação covalente com outro átomo que faz parte de uma molécula como álcool, fenol para algum outro composto. A estrutura de Lewis deste grupo é apresentada abaixo:
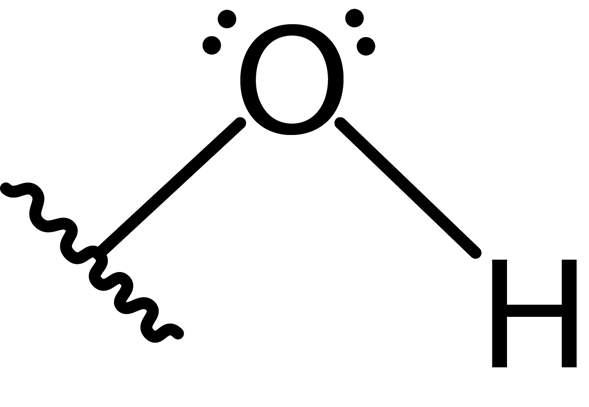
Devido à presença dos dois pares de elétrons livres no átomo de oxigênio e nas duas ligações covalentes, o grupo hidroxila possui geometria angular com um ângulo de aproximadamente 104 °, ligeiramente menor que o ângulo tetraédrico. O comprimento da ligação oxigênio-hidrogênio é de cerca de 0.97 Angstroms.
Grupo hidroxila, radical hidroxila e ânion hidróxido
É muito comum confundir o grupo hidroxila com radical hidroxil e ânion hidróxido, uma vez que todos são formados pelos mesmos dois átomos, no entanto, esses termos não se referem ao mesmo.
Por um lado, o radical hidroxil difere do grupo hidroxila, no qual é um radical livre com um número ímpar de elétrons de valência e também não está ligado a nenhum outro átomo ou grupo de átomos (e é por isso que é informado de graça).
Apesar dessas diferenças, muitas pessoas usam erroneamente o termo radical hidroxil para se referir ao grupo hidroxila quando presente em uma molécula.
O ânion hidróxido, por outro lado, é um íon com uma carga negativa formada por hidrogênio e oxigênio, enquanto o grupo hidroxila é um grupo neutro.
Além disso, enquanto o grupo hidroxila está sempre ligado a uma molécula por meio de uma ligação covalente, compostos que contêm íons hidróxidos têm ligação de íons entre este e algum metal, como sódio, lítio ou potássio.
Pode atendê -lo: quais são o ânodo e o cátodo?Exemplos de grupo hidroxila
Álcoons
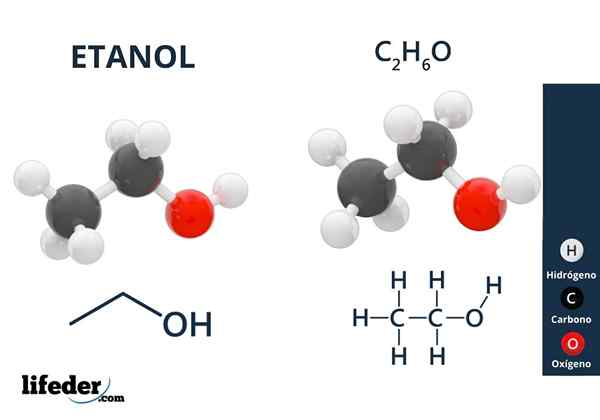 Etanol
Etanol Os álcoois têm grupos hidroxila ligados a um carbono alifático. Exemplos de álcoois são:
- Álcool metílico.
- Etanol.
- Álcool isopropílico.
Fenóis
Os fenóis são caracterizados por ter um grupo hidroxila diretamente ligado a um anel aromático. Alguns exemplos de fenóis comuns são:
- Fenol.
- Alfa e beta-naftol.
- Ortho, Goal e Cresol.
Carboidratos
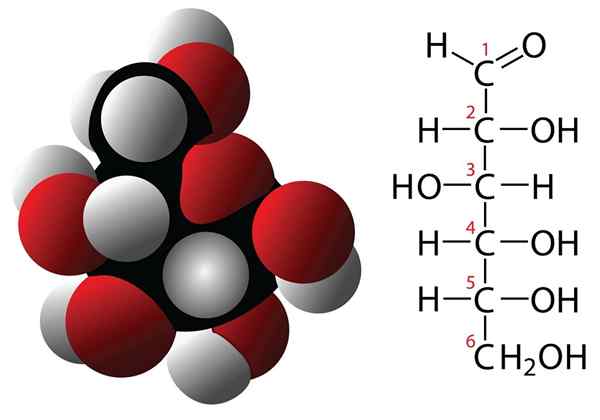 Molécula de fórmula molecular e glicose
Molécula de fórmula molecular e glicose Os carboidratos são compostos com 3 ou mais átomos de carbono que são caracterizados por ter uma fórmula empírica formada por carbonos e moléculas de água. Esses compostos geralmente têm vários grupos hidroxilli, o que os torna muito solúveis na água. Alguns exemplos de carboidratos são:
- Glicose.
- Frutose.
- Sacarose.
Ácidos carboxílicos
O grupo funcional carboxil presente nos ácidos carboxílicos corresponde a um dos grupos funcionais mais ácidos que uma molécula orgânica pode ter. Esses compostos geralmente são ácidos fracos ao compará -los com alguns ácidos minerais, mas podem se tornar consideravelmente ácidos, dependendo de sua estrutura.
A acidez do grupo carboxil é devido à presença de um grupo hidroxila ligado a um grupo carbonil, que estabiliza a carga negativa do ânion que se forma quando o hidroxila produz seu próton. Alguns exemplos de ácidos carboxílicos são:
- Ácido acético.
- Ácido benzóico.
- Ácido trifluoroacético.
Ácidos sulfônicos
Os ácidos sulfônicos são compostos orgânicos formados pela reação entre alguns compostos orgânicos e ácido sulfúrico ou dióxido de enxofre. Esses tipos de compostos têm um grupo hidroxila e, em geral, são ácidos bastante fortes, comparáveis ao ácido sulfúrico.
Alguns exemplos de ácidos sulfônicos são:
- Ácido pentossulfônico.
- Orto, objetivo e isômeros de ácido toluensulfônico.
- Ácido benzeulfônico.
Ácidos inorgânicos
Grupos hidroxila não apenas aparecem em compostos orgânicos. Muitos compostos inorgânicos também os possuem, em particular os ácidos oxácidos. Nesses casos, o grupo hidroxila está diretamente ligado a um não -metal, geralmente diferente de carbono.
Alguns exemplos de ácidos inorgânicos que possuem grupos hidroxila, juntamente com o não -metal ao qual está ligado, são:
- Ácido hipocloroso, no qual o grupo hidroxila está ligado a um átomo de cloro.
- Ácido sulfúrico, que possui dois grupos hidroxila ligados a um átomo de enxofre.
- Ácido fosfórico, no qual os três grupos hidroxila estão ligados a um átomo de fósforo.

