Características da Globina, Estrutura, Função e Alterações
- 786
- 61
- Melvin Mueller
O Globin É uma estrutura de natureza proteína organizada em forma esférica ou globular, sendo de onde seu nome vem. Essa estrutura é do tipo terciário e é caracterizada por ser complexa, pois as dobras da cadeia de aminoácidos para formar a esferoproteína. Existem vários tipos de cadeias globinas e estas foram classificadas em letras gregas: Alfa, Beta, Delta, Gamma, Epsilon e Zeta.
Os aminoácidos que compõem a estrutura primária da proteína variam de acordo com as espécies às quais pertencem (humanos ou animais). Também existem variações dentro da mesma espécie de acordo com o estado atual da vida do organismo (vida embrionária, vida fetal ou pós -nascimento).
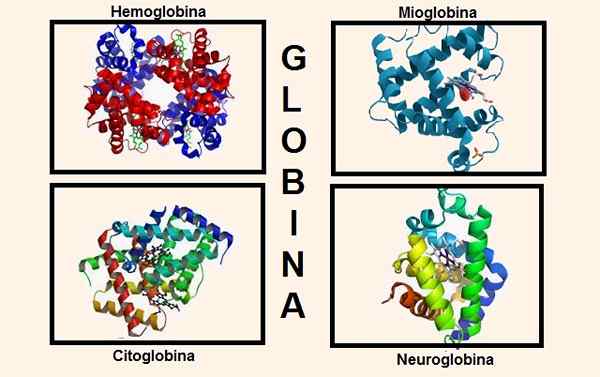
 Diferentes estruturas contendo globina em sua composição. Fontes: Wikipedia.com/Biancadescals [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]/O uploader original foi proteinboxbot na Wikipedia inglesa. [Domínio Público]/Wikipedia.com
Diferentes estruturas contendo globina em sua composição. Fontes: Wikipedia.com/Biancadescals [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]/O uploader original foi proteinboxbot na Wikipedia inglesa. [Domínio Público]/Wikipedia.com Informações genéticas para a síntese das várias cadeias globinas estão contidas em vários cromossomos. Por exemplo, globinas de cadeia alfa são encontradas no cromossomo 16, enquanto as informações genéticas de beta, delta, gama e epsilon estão no cromossomo 11.
[TOC]
Caracteristicas
A globina faz parte de estruturas importantes do corpo, por exemplo, as mais relevantes são: hemoglobina e mioglobina.
A hemoglobina contém quatro cadeias globinas (Alfa 1 e Alfa 2) e (beta 1 e beta 2). Cada globina tem uma replicação em que protege o grupo Hemo.
Por outro lado, há mioglobina. Que tem uma estrutura menos complexa que a hemoglobina. Isso apresenta um polipeptídeo globular de faixa única organizada secundária.
Até recentemente, acreditava -se que essas eram as únicas substâncias que continham globina em seres superiores, mas hoje mais dois são conhecidos que têm globina em sua constituição: citoglobina e neuroglobina.
A citoglobina está presente na maioria dos tecidos e está especialmente localizada no tecido conjuntivo, assim como foi encontrado na retina.
Por sua vez, a neuroglobina prefere o tecido nervoso, daí seu nome. A neuroglobina foi encontrada em células nervosas cerebrais localizadas no nível do córtex cerebral, bem como em outros locais como o tálamo, o hipotálamo, o hipocampo e o cerebelo.
Pode atendê -lo: taxonomia linneana de seres vivosNo entanto, eles não são os únicos locais, porque fora do sistema nervoso pode ser encontrado em ilhotas de Langerhans do pâncreas e na retina.
Estrutura
Existem 6 tipos diferentes de cadeias de globina que são designadas com as letras do alfabeto grego: alfa (α), beta (β), gama (γ), delta (δ), epsilon (ε) e zeta (ζ). Essas cadeias pertencem à família de globinas, mas diferem entre si no número de aminoácidos que possuem.
Esses polipeptídeos têm uma estrutura primária, secundária e terciária. A cadeia simples de aminoácidos representa a estrutura primária. Quando a corrente é enrolada formando espirais ou hélices compõem a estrutura secundária.
Se essa estrutura se dobrar muitas vezes por si mesma, forma uma estrutura globular correspondente à estrutura terciária.
Da mesma forma, eles só podem adquirir a forma quaternária quando 4 moléculas ou cadeias de globina são combinadas de forma terciária.
Isso é apresentado na estrutura complexa da hemoglobina. No entanto, na mioglobina, é diferente. Nesse caso, a Globin é apresentada como monômero, ou seja, possui uma única cadeia peptídica que é organizada em dobras, criando 8 hélices (estrutura secundária).
Tanto a hemoglobina quanto a casa de mioglobina um grupo Hemo dentro de sua estrutura complexa.
Hemoglobina
Nesta molécula, 2 cadeias alfa globinas e 2 cadeias beta são unidas. É assim que eles estão perfeitamente acoplados para abrigar o grupo Hemo em seu centro, além de ferro.
Entre essas estruturas, existem sindicatos fracos e sindicatos fortes. Nos sindicatos fracos, 19 aminoácidos participam e a união ocorre da seguinte maneira: a cadeia Alfa 1 se une à cadeia beta 2 e a cadeia Alfa 2 se junta à cadeia beta 1.
Enquanto, 35 aminoácidos e as cadeias que se juntam são: Alfa 1 Chain se une à corrente beta 1 e a cadeia Alfa 2 se une à corrente beta 2 2.
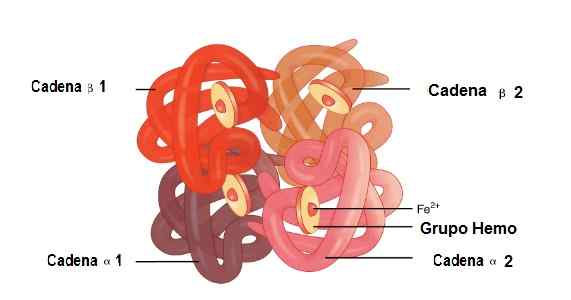 Localização das cadeias Alfa 1 e Alfa 2, Beta 1 e Beta 2 na estrutura da hemoglobina. Fonte: OpenX College [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)] imagem editada (traduzida para o espanhol)
Localização das cadeias Alfa 1 e Alfa 2, Beta 1 e Beta 2 na estrutura da hemoglobina. Fonte: OpenX College [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)] imagem editada (traduzida para o espanhol) Mioglobina
Na mioglobina, um grupo de proteínas globulares também está presente, mas neste caso há uma única cadeia peptídica que consiste em 153 aminoácidos. Sua disposição espacial é secundária e apresenta 8 hélices alfa.
Pode atendê -lo: oligotos: para que são eles, para que servem e para que sãoEssa estrutura de proteínas coloca estrategicamente aminoácidos hidrofóbicos na estrutura, enquanto os aminoácidos hidrofílicos ou polares são encontrados para fora.
Este design é perfeito para abrigar o grupo Hemo dentro (parte hidrofóbica). Isso se liga à proteína por ligações não -covalentes.
Citoglobina
Foi descoberto em 2001 e diz -se que é um tipo de hemoglobina, mas difere na medida em que é hexacoordinado, enquanto a hemoglobina e a mioglobina são pentacoordinadas. Isso tem a ver com a posição adotada pelo aminoácido de histidina próximo ao grupo Hemo.
Neuroglobina
Sua descoberta foi feita em 2000. A neuroglobina é um monômero que possui 150 aminoácidos, portanto é muito semelhante à mioglobina. A estrutura da neuroglobina tem uma semelhança entre 21 e 25% com mioglobina e hemoglobina.
Funções
Como a Globin não está sozinha no corpo, mas fazendo parte de certas estruturas, são mencionadas as funções que cada uma delas cumpre:
Hemoglobina
Está localizado dentro dos eritrócitos. É responsável por consertar e transportar oxigênio dos pulmões para os tecidos. Bem como o corpo de dióxido de carbono, fazendo a rota oposta.
Mioglobina
O grupo Hemo localizado em Globin tem a função de armazenar moléculas de oxigênio para oxigenar o músculo cardíaco e o músculo esquelético.
Citoglobina
Acredita -se que esta proteína influencie a proteção da hipóxia e dos estados de estresse oxidativo nos tecidos. Também se pensa que o oxigênio arterial pode transportar para o cérebro.
Neuroglobina
Pensa -se que a neuroglobina tem a capacidade de consertar oxigênio, monóxido carbono e óxido nítrico.
No entanto, ainda não se sabe com certeza qual é a função da neuroglobina, mas acredita -se que esteja relacionada à regulação da hipóxia e da isquemia cerebral. Especialmente atuaria como um neuroprotetor.
Pode atendê -lo: teoria do transformismo de LaMarckComo a neuroglobina possui uma estrutura semelhante à hemoglobina e mioglobina, especula -se que ela possa participar do fornecimento de oxigênio no nível neuronal. Acredita -se também que ele possa eliminar os radicais livres e o nitrogênio que ocorrem na cadeia respiratória.
Em relação ao óxido nítrico, acredita -se que elimine quando o oxigênio é normal e o produz em processos de hipóxia de não2.
Alterações
As cadeias alfa e beta de globina são codificadas por diferentes genes localizados nos cromossomos 16 e 11, respectivamente.
Indivíduos que têm hemoglobina S (anemia falciforme ou drapanocítica) têm um defeito na cadeia beta de globina. O defeito consiste em uma substituição de bases de nitrogênio no nível do nucleotídeo número 20 do gene envolvido, onde há uma mudança de adenina por um timin.
Mutações no gene βs do cromossomo 11 origina diferentes halopes de globinas chamados: Senegal, Camarões, Benín, Bantú ou Car e Ásia ou Árabe-Indiano.
Saber o tipo de haplótipo apresentado por pacientes com anemia falciforme é importante epidemiológico, pois permite conhecer a distribuição de diferentes haplótipos, mas também essas informações fornecem dados importantes para conhecer o prognóstico da doença.
Por exemplo: sabe -se que o halótipo Bantu é mais grave, enquanto o tipo senegal e asiático são mais brandos.
As diferenças entre um haplótipo e outra mentira na quantidade de hemoglobina f que eles possuem. Uma porcentagem maior de hemoglobina F e menor prognóstico da hemoglobina. Menos hemoglobina F e mais prognóstico pior da hemoglobina.
Essas mutações são herdadas autossomicamente junto com a mutação h hemoglobina s.
Referências
- "Globin." Wikipedia, enciclopédia livre. 19 de outubro de 2018, 13:44 UTC. 11 de julho de 2019, 17:26, Wikipedia.org
- “Myoglobin." Wikipedia, enciclopédia livre. 7 de julho de 2019, 21:16 UTC. 11 de julho de 2019, 20:42, Wikipedia.org
- Durán C, Morales O, Echeverri S, Isaza M. Halótipos do gene da beta globina nos portadores de hemoglobina s na Colômbia. 2012 biomédico; 32: 103-111. Disponível em: Scielo.org
- Forrellat m, hernández p. Neuroglobina: novo membro da família Globinas. Rev Cuban Rev Immunol Hemother 2011; 27 (3): 291-296. Disponível em: Scielo.SLD
- “Citoglobina." Wikipedia, enciclopédia livre. 1 de setembro de 2017, 17:26 UTC. 12 de julho de 2019, 00:28 Wikipedia.org
- « Características de heteropolissacarídeos, estrutura, funções
- Sintomas, causas e tratamentos paranóicos da esquizofrenia »

