Estrutura, características, funções gliceraldeído, características, funções
- 859
- 142
- Gilbert Franecki
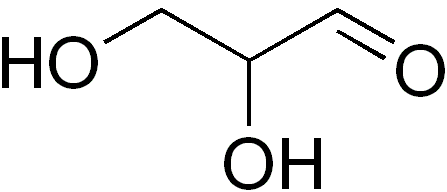
Ele gliceraldeído É o único monossacarídeo de três carbonos, sendo por sua vez a única triosa. É também um aldotriosa porque possui um grupo de aldeído. A palavra gliceraldeído vem da combinação de glicerina e aldeído. Isso ocorre porque o gliceraldeído é semelhante à glicerina, mas carbono (c-1) é um aldeído.
A síntese química do gliceraldeído é realizada por diferentes métodos, por exemplo, usando enzimas. O gliceraldeído é uma molécula bastante reativa, sendo capaz de formar ultrajante entre proteínas.
 Fonte: DRTW na Dutch Wikedia [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]
Fonte: DRTW na Dutch Wikedia [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]] [TOC]
Estrutura
O gliceraldeído tem um centro assimétrico ou quiral (o átomo de carbono 2, C-2). Ele forma dois enantiômeros D (Dextrogyr) e L (Levógiro), que giram o plano de luz polarizada em direções opostas: o D-gliceraldeído o transforma para a direita e o L-gliceraldeído à esquerda.
A rotação óptica específica do D-gliceraldeído, a 25 ºC, é +8,7º, e a rotação óptica específica do D-gliceraldeído, a 25 ° C, é -8,7º. D-gliceraldeído é freqüentemente encontrado na natureza, principalmente como gliceraldeído 3-fosfato.
A configuração l-gliceraldeído é usada como a referência padrão para carboidratos. Nas moléculas biológicas, o D-Sugar é abundante. O átomo de carbono 3 (C-3) de gliceraldeído é um grupo hidroximetileno (-ch2OH).
Caracteristicas
Os cristais gliceraldeído são incolores e têm um sabor doce. A fórmula empírica deste açúcar é C3H6QUALQUER3 e seu peso molecular é 90 g/mol.
Em solução aquosa, o dl-gliceraldeído está presente principalmente como aldeidrol, que é uma forma hidratada de aldeído. Dl-gliceraldehido cristalino é Dimic.
A análise dos cristais gliceraldeído por raios-X mostrou que possui anéis de 1,4 dioxan com todos os substituintes na orientação equatorial.
Em solução aquosa, gliceraldeído experimenta auto -oxidação gerando radicais livres. Isso está associado ao rápido consumo de oxigênio.
Pode atendê -lo: protocooperaçãoA velocidade de consumo de oxigênio diminui lentamente na presença de dismutase de superóxido. Isso sugere que há formação de superóxido durante a autooxidação gliceraldeído. A passagem limitadora do autoxid gliceraldeído
A síntese de D-gliceraldeído é catalisada por aminoácidos primário e secundário, sendo favorecido a baixos valores de pH (de 3 a 4).
Funções
Em reticulação entre proteínas
A interação proteína-proteína é um mecanismo molecular de múltiplos processos biológicos complexos. Essas interações podem ser transitórias, sendo a interação da proteína de uma via metabólica ou tradução de sinal.
A reticulação química constitui um método direto para identificar interações transitórias e estáveis de proteína-proteína.
A técnica de reticulação entre a proteína consiste na formação de ligações covalentes, para as quais agentes que possuem grupos reativos bifuncionais que reagem com grupos amino e grupos de resíduos de aminoácidos são usados.
Especificamente, os agentes reagem com grupos primários de aming (como o epsilon-amino do desperdício das lisinas) e formam intercepção tanto dentro de uma subunidade de proteínas quanto entre subunidades de proteínas.
Há uma grande variedade de agentes disponíveis comercialmente. Embora o GlyCeraldeyde seja um agente de reticulação, existem outros agentes mais populares, como o glutaraldeído. Isso ocorre porque o gluteraldeído mantém a rigidez estrutural da proteína, o que é um requisito importante em muitos estudos.
Outros agentes populares são imideradores homobifuncionais, que variam no comprimento do braço espaçador entre seus grupos reativos. Alguns exemplos de imidoesters são o dimetil apimidato (DMA), o dimetil suberimidado (DMS) e o dimetil pimilimidato (DMP).
Pode atendê -lo: homopolissacarídeos: características, estrutura, funções, exemplosEm reticulação entre microesferas de gelatina
As microesferas de gelatina têm o potencial de servir para liberação controlada de medicamentos. Isso ocorre porque essas microesferas não são tóxicas e que seus produtos são facilmente excretados. No entanto, a gelatina é um polímero solúvel, por isso deve ser quimicamente modificado para servir como um sistema de transporte de drogas.
D, L-gliceraldeído pode ser considerado um agente de reticulação não tóxico (a dose letal, DL50 I.p. Em ratos, é 2000 mg/kg). Além disso, no corpo humano, o D-gliceraldeído é fosforilado pela triosa quinase. Dessa forma, o gliceraldeído de 3 fosfato que entra na glicólise é formado.
O tratamento de microesferas de gelatina com D, L-gliceraldeído por 24 horas produz microesferas com vários aminoácidos de lisina livre reduzida. Portanto, a capacidade das microesferas de prolongar, por exemplo, o efeito do hidroclurido da clodinina, que é anti -hipertensivo.
As microesferas foram administradas por injeção subcutânea a albinas e ratos zombeteiros. Após a injeção, a pressão arterial sistólica diminuiu por duas horas, posteriormente recuperando seu valor basal. Os tecidos do local de injeção foram analisados e as microfeads não foram encontradas, embora a inflamação tenha sido observada.
Em reações prebióticas
Sob condições prebióticas - como aquelas que deveriam ter a terra primitiva - o formaldeído poderia ter servido para a síntese de gliceraldeído, um intermediário químico envolvido nos processos químicos que poderiam ter originado a vida.
A hipótese anterior é baseada no fato de que tanto a glicólise quanto a fotossíntese têm gliceraldeído 3-fosfato como intermediário metabólico.
Foi proposto um modelo químico que explica a biossíntese de gliceraldeído de formaldeído através de uma via cíclica. A síntese de gliceraldeído ocorre com a adição de formaldeído a uma triosa (gliceraldeído ↔ di -hidroxiacetona) para produzir uma tetrosa (↔ aldotrosa ↔ ↔ ↔ ↔ ↔ ↔ ↔ cet.
Pode atendê -lo: Erthers: características, estrutura, funçõesA adição de formaldeído ao glicaldeído completa o ciclo. A síntese de duas moléculas de triioso de seis moléculas de formaldeído ocorre.
Em geral, acredita -se que a síntese prebiótica de açúcares que a reação de Formosa está envolvida, na qual o formaldeído na presença de uma pequena quantidade de glicaldeído é convertida em açúcar por reações de condensação aldólica.
Foi proposto que a oxidação prebiótica de açúcar (glicaldeído, triosas, tetrosas) produziu poli -hidroxiácidos que atuam como substâncias auto -otalíticas.
A conversão de gliceraldeído em ácido lático e ácido glicérico, óxido dependente de hidróxido de ferro, aponta para os oligoéstres desses hidroxiácidos ocorreram na superfície deste material.
Referências
- Breslow, r., Ramalingam, v., Appaeee, c. 2013. Catálise da síntese de gliceraldeído por aminoácidos primário ou secundário em condições prebióticas uma função de pH. Origem da biosfera de evolução da vida. Doi 10.1007/S11084-013-9347-0.
- Carey, f. PARA., Giuliano, r. M. 2016. Química orgânica. McGraw-Hill, Nova York.
- Robyt, J.F. 1998. Itens essenciais de química de carboidratos. Springer, Nova York.
- Thornalley, p., Wolff, s., Crabbe, j., Stern, a. 1984. A autoxidação de gliceraldeído e outros monossacarídeos simples sob catalisados fisiológicos por buffers. Biochimica et Biophysica Acta, 797, 276-287.
- Vandelli, m.PARA., Rivas, f., Guerra, p., Forni, f., Arletti, r. 2001. Microesferas gelatina reticulada com d, L-gliceraldeído como um potencial sistema de entrega drarug: preparação, caracterização, estudos in vitro e in vivo. International Journal of Pharmaceutics, 215, 175-184.
- Weber, a.eu. 1987. O Modelo de Trose: Glyceraldeído como fonte de energia e monômeros para reações de condensação prebióticas. Origens da vida, 17, 107-19.

