Conceito de geometria molecular, tipos e exemplos
- 1254
- 171
- Terrell Stokes
O Geometria molecular qualquer estrutura molecular É a distribuição espacial de átomos em torno de um átomo central. Os átomos representam regiões onde há uma alta densidade eletrônica e, portanto, são considerados grupos eletrônicos, independentemente dos links que se formam (simples, duplo ou triplo).
A geometria molecular de um elemento pode caracterizar algumas de suas propriedades físicas ou químicas (ponto de ebulição, viscosidade, densidade, etc.). Por exemplo, a estrutura molecular da água determina sua solubilidade.
 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Este conceito nasce dos dados combinados e experimentais de duas teorias: a do Link do Valencia (TEV) e a repulsão dos pares eletrônicos da camada de Valencia (RPECV). Enquanto o primeiro define os links e seus ângulos, o segundo estabelece geometria e, consequentemente, a estrutura molecular.
Quais formas geométricas são capazes de adotar moléculas? As duas teorias anteriores contribuem com as respostas. De acordo com o RPECV, os átomos e pares de elétrons livres devem ser organizados no espaço de forma que a repulsão eletrostática entre eles diminua para o máximo.
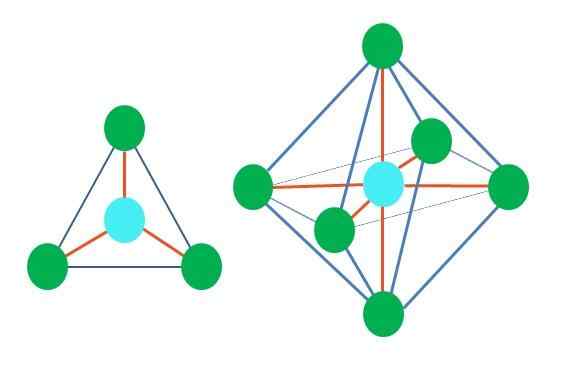
Portanto, as formas geométricas não são arbitrárias, mas procuram o design mais estável. Por exemplo, na imagem superior, um triângulo pode ser visto à esquerda e à direita um octaedro. Os pontos verdes representam os átomos e as linhas laranja dos links.
No triângulo, os três pontos verdes são orientados em uma separação de 120º. Este ângulo, que é igual ao do link, permite que os átomos se repelem o possível. Portanto, uma molécula com um átomo central ligado a três outros adotará uma geometria trigonal plana.
No entanto, o RPECV prevê que um par de elétrons livres no átomo central distorcerá a geometria. No caso do plano trigonal, esse torque empurrará os três pontos verdes, resultando em uma geometria de pirâmide trigonal.
O mesmo também pode acontecer com o octaedro da imagem. Nela todos os átomos são separados da maneira mais estável possível.
[TOC]
Como saber com antecedência a geometria molecular de um átomo x?
Para isso, também é necessário considerar elétrons livres como grupos eletrônicos. Estes, juntamente com os átomos, definirão o que é conhecido como o Geometria eletrônica, que é um companheiro inseparável da geometria molecular.
Da geometria eletrônica e tendo detectado os pares de elétrons livres pela estrutura de Lewis, pode -se estabelecer qual geometria molecular será. A soma de todas as geometrias moleculares fornecerá um esboço da estrutura global.
Tipos de geometria molecular
Como pode ser visto na imagem principal, a geometria molecular depende de quantos átomos cercam o átomo central. No entanto, se alguns elétrons estiverem presentes sem compartilhar, ele modificará a geometria porque ocupa muito volume. Portanto, exerce um efeito estérico.
De acordo com isso, a geometria pode apresentar uma série de formas características para muitas moléculas. E é aqui que surgem os diferentes tipos de geometria molecular ou estrutura molecular.
Quando a geometria é igual à estrutura? Ambos denotam o mesmo apenas nos casos em que a estrutura não tem mais de um tipo de geometria; Caso contrário, todos os tipos presentes devem ser considerados e dar à estrutura um nome global (linear, ramificado, globular, plano, etc.).
Pode servir você: hidraceAs geometrias são especialmente úteis para explicar a estrutura de um sólido de suas unidades estruturais.
Linear
Todas as ligações covalentes são direcionais, então o link A-B é linear. Mas a molécula será linear2? Nesse caso, a geometria é simplesmente representada como: B-A-B. Os dois átomos de B são separados por um ângulo de 180º e, de acordo com o Tev, um deve ter orbitais híbridos SP.
Angular
 Fonte: Gabriel Bolívar
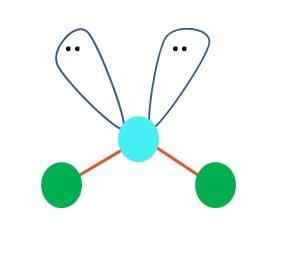
Fonte: Gabriel Bolívar Uma geometria linear para a molécula AB pode ser assumida em primeira instância2; No entanto, é essencial desenhar a estrutura de Lewis antes de chegar a uma conclusão. Desenhado a estrutura de Lewis, você pode identificar o número de pares de elétrons incomuns (:) no átomo de um.
Quando é assim, nos pares de elétrons, os dois átomos de B para baixo, trocando seus ângulos. Como resultado, a molécula linear B-A-B acaba se tornando um V, um bumerangue ou uma geometria angular (imagem superior)
A molécula de água, H-O-H, é o exemplo ideal para esse tipo de geometria. No átomo de oxigênio, existem dois pares de elétrons sem compartilhar que são orientados em um ângulo aproximado de 109º.
Por que esse ângulo? Porque a geometria eletrônica é tetraédrica, que possui quatro vértices: dois para átomos H e dois para elétrons. Na imagem superior, observe que os pontos verdes e os dois "lóbulos com olhos" desenham um tetraedro com o ponto azulado em seu centro.
Se o OR não tivesse elétrons livres, a água formaria uma molécula linear, sua polaridade diminuiria e os oceanos, mares, lagos etc., Eles provavelmente não existiriam como se conhecem.
Tetraédrico
 Fonte: Gabriel Bolívar
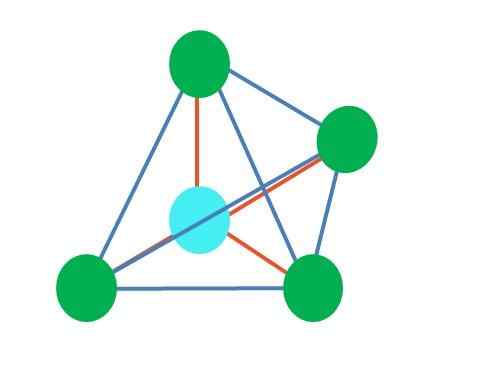
Fonte: Gabriel Bolívar A imagem superior representa geometria tetraédrica. Para a molécula de água, sua geometria eletrônica é tetraédrica, mas ao eliminar pares sem elétrons, pode -se notar que é transformado em uma geometria angular. Isso também é simplesmente observado eliminando dois pontos verdes; Os dois restantes desenharão o V com o ponto azul.
E se, em vez de dois pares de elétrons livres, havia apenas um? Então haveria um plano trigonal (imagem principal). No entanto, ao eliminar um grupo eletrônico, o efeito estérico produzido pelo par de elétrons livres não é evitado. Portanto, distorce o plano trigonal para uma pirâmide de base triangular:
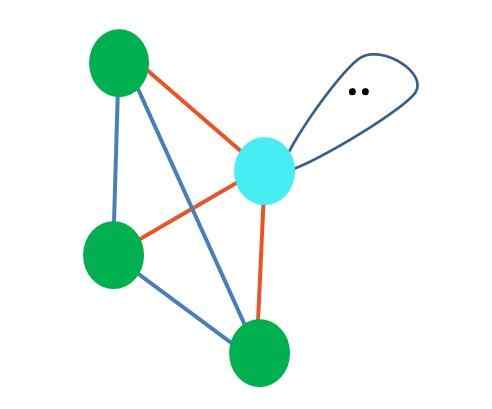 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Embora a geometria molecular trigonal e a pirâmide trigonal e tetraédrica sejam diferentes, a geometria eletrônica é a mesma: tetraédrica. Portanto, a pirâmide trigonal não conta como geometria eletrônica?
A resposta é não, uma vez que é o produto da distorção causada pelo "lobo com os olhos" e seu efeito estérico, e disse que a geometria não leva em consideração as distorções posteriores.
Por esse motivo, é sempre importante determinar a primeira geometria eletrônica com a ajuda das estruturas de Lewis antes de definir a geometria molecular. A molécula de amônia, NH3, É um exemplo de geometria molecular pirâmide trigonal, mas com geometria eletrônica tetraédrica.
Bipirâmide trigonal
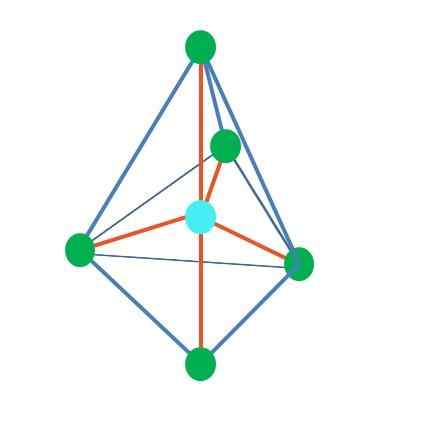 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Até agora, com exceção da geometria linear, na pirâmide tetraédrica, angular e trigonal, seus átomos centrais têm hibridação sp sp3, De acordo com o Tev. Isso significa que, se seus ângulos de link foram determinados experimentalmente, eles devem estar em torno de 109º.
Pode atendê -lo: Química Aplicada: Objeto de Estudo, Ramos, Importância, ExemplosA partir da geometria dihararmidal trigonal, existem cinco grupos eletrônicos ao redor do Atom Central. Na imagem superior, você pode ver com os cinco pontos verdes; três na base triangular e dois em posições axiais, que são os vértices superior e inferior da pirâmide.
Que hibridação então tem o ponto azul? Precisa de cinco orbitais híbridos para formar ligações simples (laranja). Isso o alcança através dos cinco orbitais sp3d (Produto da mistura de um orbital s, três p e um d).
Ao considerar cinco grupos eletrônicos, a geometria já está exposta, mas com pares de elétrons sem compartilhar, ela sofre novamente distorções que geram outras geometrias. Da mesma forma, surge a seguinte pergunta: esses pares podem ocupar qualquer posição da pirâmide? São: o axial ou o equatorial.
Posições axiais e equatoriais
Os pontos verdes que compõem a base triangular estão em posições equatoriais, enquanto os dois nas extremidades superior e inferior, em posições axiais. Onde preferencialmente o par de elétrons será localizado sem compartilhar? Nessa posição que diminui para a repulsão eletrostática máxima e efeito estérico.
Na posição axial, o par de elétrons tornaria a “pressão” perpendicular (90º) na base triangular, enquanto que, se estivesse em posição equatorial, os grupos eletrônicos restantes da base seriam separados 120º e pressionavam as duas extremidades a 90º (em vez de três, como na base).
Portanto, o átomo central procurará orientar seus pares livres de elétrons em posições equatoriais para gerar geometrias moleculares mais estáveis.
Oscilando e forma de t
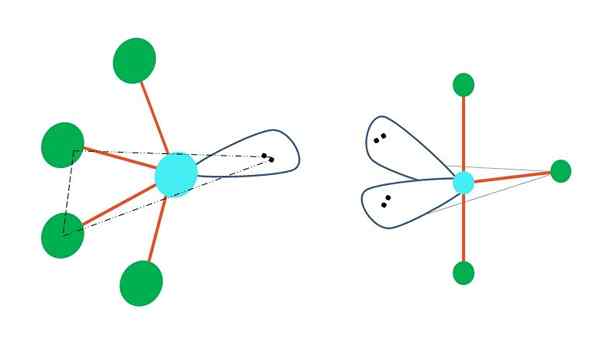 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Se um ou mais de seus átomos livres de elétrons fossem substituídos em geometria bipirâmida trigonal, diferentes geometrias moleculares também teriam.
À esquerda da imagem superior, a geometria muda para a forma oscilante. Nele, o torque livre de elétrons empurra o restante dos quatro átomos na mesma direção, dobrando seus links para a esquerda. Observe que este torque e dois dos átomos estão no mesmo plano triangular da bipiramida original.
E à direita da imagem, a geometria na forma de t. Essa geometria molecular é o resultado de substituir dois átomos por dois pares de elétrons, resultando em que os três átomos restantes se alinham no mesmo plano que desenha exatamente uma letra t.
Então, para uma molécula do tipo AB5, Isso adota geometria bipirâmida trigonal. No entanto, ab4, Com a mesma geometria eletrônica, adotará a geometria oscilante; e ab3, Geometria em forma de T. Em todos eles terão (geralmente) a hibridação SP3d.
Para determinar a geometria molecular, é necessário desenhar a estrutura de Lewis e, portanto, sua geometria eletrônica. Se isso for bipirâmide trigonal, os pares sem elétrons serão descartados, mas não seus efeitos estéricos no restante dos átomos. Assim, pode ser perfeitamente discernido entre as três geometrias moleculares possíveis.
Octaédrico
À direita da imagem principal, a geometria molecular octaédrica é representada. Este tipo de geometria corresponde a compostos AB6. Ab4 Eles formam a base quadrada, enquanto os dois restantes se posicionam em posições axiais. Assim, são formados vários triângulos equiláteis, que são os rostos do octaedro.
Pode atendê -lo: energia de ativaçãoAqui, novamente, pode haver (como em todas as geometrias eletrônicas) pares de elétrons livres e, portanto, derivam desse fato outras geometrias moleculares. Por exemplo, AB5 Com geometria eletrônica octronista, consiste em uma pirâmide com base quadrada e ab4 de um plano quadrado:
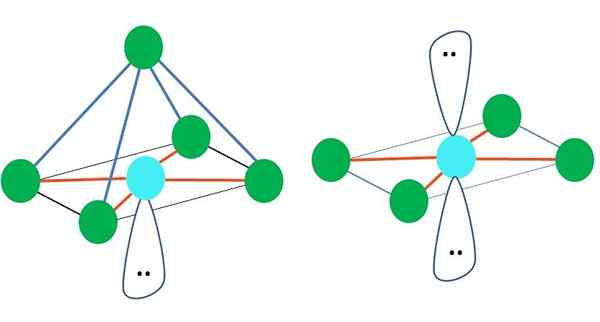 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar No caso da geometria eletrônica octronista, essas duas geometrias moleculares são as mais estáveis em termos de repulsão eletrostática. Na geometria plana quadrada, os dois pares de elétrons são separados de 180º.
O que é hibridação para o átomo nessas geometrias (ou estruturas, se for a única)? Novamente, o Tev estabelece que é SP3d2, Seis orbitais híbridos, que permitem orientar grupos eletrônicos nos vértices de um octaedro.
Outras geometrias moleculares
Modificando as bases das pirâmides mencionadas até agora, algumas geometrias moleculares mais complexas podem ser obtidas. Por exemplo, a bipiramida pentagonal é baseada em um Pentágono e os compostos que formam com fórmula geral AB7.
Como as outras geometrias moleculares, a substituição de átomos B por pares sem elétrons distorcerá a geometria para outras formas.
Além disso, compostos AB8 Eles podem adotar geometrias como o antiprismo quadrado. Algumas geometrias podem se tornar muito complicadas, especialmente para fórmulas AB7 De agora em diante12).
Exemplos de geometria molecular
Uma série de compostos será mencionada abaixo para cada uma das principais geometrias moleculares. Como exercício, as estruturas de Lewis podem ser desenhadas para todos os exemplos e certificar se, dada a geometria eletrônica, as geometrias moleculares forem obtidas à medida que são listadas abaixo.
Geometria linear
-Etileno, h2C≡CH2
-Cloreto de berílio, Becl2 (Cl-BE-CL)
-Dióxido de carbono, CO2 (O = c = o)
-Nitrogênio, n2 (N tal)
-Mercury Dibromure, HGBR2 (BR-HG-BR)
-Ânion triyoduro, eu3- (I-i-i)
-Ácido modehydric, hcn (h-ntalc)
Seus ângulos devem ser 180º e, portanto, ter hibridação SP.
Geometria Angular
-A água
-Dióxido de enxofre, então2
-Dióxido de nitrogênio, não2
-Ozônio, ou3
-Amiduro Anion, NH2-
Plana trigonal
-Trifluoreto de bromo, BF3
-Tricloreto de alumínio, ALCL3
-Ânion nitrato, não3-
-Ânion carbonato, CO32-
Tetraédrico
-GAS METANO, CH4
-Tetracloreto de carbono, CCL4
-Cátion de amônio, NH4+
-Ânion sulfato, então42-
Pirâmide trigonal
-Amônia, NH3
-Hidronio cátion, h3QUALQUER+
Bipirâmide trigonal
-Fosforus pentafluoruro, pf5
-Pentacloreto de Antimônio, SBF5
Oscilando
Tetrafluoreto de enxofre, SF4
Forma de t
-Tricloreto de iodo, ICL3
-Trifluoreto de cloro, clf3 (Ambos os compostos são conhecidos como interhalógenos)
Octaédrico
-Hexafluoruro de enxofre, sf6
-Selênio Hexafluoruro, SEF6
-Hexaflorofosfato, pf6-
Para culminar, a geometria molecular é a que explica as observações das propriedades químicas ou físicas do assunto. No entanto, é orientado de acordo com a geometria eletrônica, para que este último deve ser sempre determinado antes do primeiro.
Referências
- Whitten, Davis, Peck e Stanley. Química. (8ª ed.). Cengage Learning, p. 194-198.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição., p. 23, 24, 80, 169). Mc Graw Hill.
- Marcos e. Tuckerman. (2011). Geometria molecular e teoria VSEPR. Recuperado de: NYU.Edu
- Virtual Chembook, Charles e. Ophardt. (2003). Introdução à geometria molecular. Recuperado de: química.Elmhursst.Edu
- Química Librettexts. (8 de setembro de 2016). Geometria de moléculas. Recuperado de: química.Librettexts.org

