Mercúrio fulminar estrutura, propriedades, obtenção, usos
- 1966
- 593
- Pete Wuckert
Ele Mercúrio fulminado É um composto inorgânico formado pelos elementos Mercúrio (Hg), Carbono (C), Nitrogênio (N) e Oxigênio (O) (O). Sua fórmula química é HG (CNO)2. Não deve ser confundido com o cianato de mercúrio, porque, embora ambos os compostos tenham os mesmos elementos, neste último os átomos se ligam de maneira diferente.
Foi descoberto pelo químico inglês Edward Howard em 1800. No entanto, quase 200 anos antes de ter sido acidentalmente sintetizado pelo alquimista alemão Johannes Kunckel, que para a explosão não o isolou, mas deixou registros escritos dos ingredientes usados.
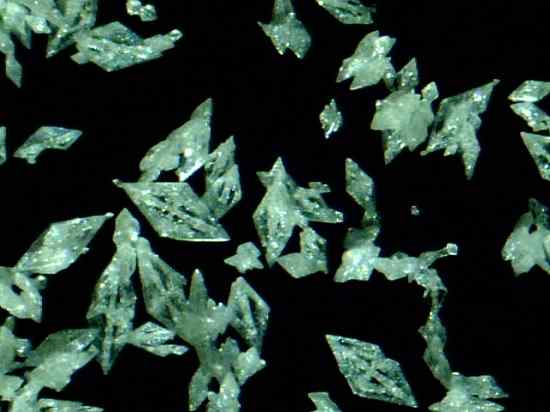
 Cristais Mercury Fulminat HG (CNO)2. Daniel Grohmann/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Cristais Mercury Fulminat HG (CNO)2. Daniel Grohmann/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. É um explosivo primário, por isso é usado em cápsulas de percussão ou explosão para promover a explosão de outras substâncias. Embora sua preparação e conservação sejam extremamente perigosas, foi amplamente utilizada no século XIX como detonador em guerra e armas de caça.
Atualmente, é usado para a detonação de poderosas cargas de dinamite na construção de túneis e estradas e mineração.
É claramente um composto extremamente perigoso que só pode ser manipulado por pessoas com profundo conhecimento sobre como lidar com explosivos.
[TOC]
Estrutura
O HG (CNO)2 É um sal de ácido fulmínico hcnO. Contém mercúrio na oxidação +2 e duas unidades CNO fulminate-.
De acordo com um estudo de raios-X realizado em 2007 na Alemanha (relatado em inglês em 2008), as moléculas de Mercury Fulminate têm a estrutura ONC-HG-CNO, onde é observado que o mercúrio está diretamente ligado aos átomos de carbono.
A união C-HG-C é linear; forma um ângulo de 180 ° e o grupo Fulminat (CNO) possui uma ligação curta de carbono-nitrogênio e uma ligação mais longa de nitrogênio-oxigênio.
O comprimento do link C-N é de 1,14-1,17 Å (Angstroms), que corresponde a um triplo link fraco. O link N-O é 1,20-1,25 Å que indica uma ligação dupla fraca. Um angstrom (Å) é uma medida de comprimento e é a parte de dez mensagens de um medidor.
Pode servir a você: Métodos de separação de misturas homogêneas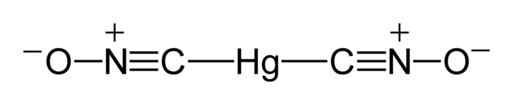 Estrutura de Lewis de Mercury Fulminat. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons.
Estrutura de Lewis de Mercury Fulminat. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons. No estado sólido, embora a união C-HG-C seja linear e o grupo CNO também seja, a união N-C-HG se desvia da linearidade em 11 °, ou seja, possui um ângulo de 169 °.
 Molécula Hg (CNO)2 Em estado sólido. Cinza = mercúrio; Preto = carbono; azul = nitrogênio; Vermelho = oxigênio. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons.
Molécula Hg (CNO)2 Em estado sólido. Cinza = mercúrio; Preto = carbono; azul = nitrogênio; Vermelho = oxigênio. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons. No entanto, de acordo com o estudo acima mencionado, em estado gasoso, a molécula completa é totalmente linear.
Nomenclatura
- Mercúrio fulminado
- Fulminado mercúrico
- Mercúrio DiFulMinate
- Mercúrio bisfulminate
- Sal de mercúrio de ácido fulmínico
- Mercúrio fulminante
- Mercúrio explosivo
Propriedades
Estado físico
Branco a laranja sólido sólido.
 HG (CNO)2 sólido umedecido. Daniel Grohmann/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
HG (CNO)2 sólido umedecido. Daniel Grohmann/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. Peso molecular
284,63 g/mol
Ponto de fusão
Não derrete. Sendo aquecido em mais de 100 ° C explorações.
Densidade
4,42 g/cm3
Solubilidade
Ligeiramente solúvel em água. Solúvel em etanol (c2H5Oh) e hidróxido de amônio (NH4OH).
Propriedades quimicas
É um composto muito explosivo e altamente sensível a golpes, impactos ou atrito. Você pode detonar facilmente com faíscas e chamas. Quando se decompõe para gases de mercúrio de forma (HG), monóxido de carbono (CO) e nitrogênio (N2).
Com ácido sulfúrico (H2SW4) Concentrado também ocorre uma detonação violenta. O ácido clorídrico dissolve -o parcialmente e o cloreto mercúrico ocorre.
De acordo com um estudo realizado em 1981, se sofrer um aquecimento controlado e muito lento, sob uma atmosfera de argônio inerte, quando atinge 120 ° C, ocorre uma decomposição não explosiva e o óxido mercúrico sólido e os gases mercúrios e os gases de mercúrio e os gases de oxigênio são formados.
É um composto que foi estudado por tempos raros por seu perigo e essas oportunidades de estudo foram muito distanciadas uma da outra a tempo. Você deve trabalhar no escuro para evitar explosões. Suas amostras devem ser mantidas debaixo d'água e sem luz.
 HG Solid (CNO)2 Mantenha debaixo d'água. Daniel Grohmann/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
HG Solid (CNO)2 Mantenha debaixo d'água. Daniel Grohmann/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. Obtenção
Após sua descoberta, houve comercialmente através das reações entre etanol (CHO3CH2OH), Mercúrio (HG) e ácido nítrico (HNO3).
Pode atendê-lo: Clausius clapeyron Equação: Para que é, exemplos, exercíciosEm um dos estudos mais importantes sobre a estrutura deste composto, os pesquisadores sugerem que, para obter maior desempenho durante sua preparação, a primeira metade do volume total de etanol deve ser adicionada à mistura HG e HNO3 Antes que os gases marrons desapareçam.
Em outras palavras, é importante que os óxidos de nitrogênio estejam presentes para que a reação prossiga.
O que acontece primeiro é a conversão de etanol em acetaldeído. De acordo com certos estudos, segue -se mais oxidação, nitração, descarboxilação e eliminação do ácido nitroso, para que o fulminat seja formado.
Eu uso como um agente de detonação de outros explosivos
Aplicações de guerra
As primeiras tentativas de usar Mercúrio fulminar como poeira explosiva para armas de fogo ficaram frustradas com a velocidade extraordinária e a violência de sua detonação.
As armas e espingardas foram destruídas por pequenas cargas deste composto. Também aconteceu com peças de artilharia e granadas em testes militares.
No entanto, em 1822, o inglês Wright o usou pela primeira vez como incêndio em seus rifles de caça esportivos. Posteriormente, na Bretanha, seu uso em mosquetes de infantaria foi implementado e depois em toda a Europa.
 No século XIX, o fulminado de Mercúrio foi usado como detonador de muitos tipos de armas de guerra. Autor: Vetsikas Dimitris. Fonte: Pixabay.
No século XIX, o fulminado de Mercúrio foi usado como detonador de muitos tipos de armas de guerra. Autor: Vetsikas Dimitris. Fonte: Pixabay. Até o início dos anos 1900, era o único detonador usado para o tiro de projéteis de qualquer tipo, até que outras alternativas com compostos mais seguros e acessíveis fossem implementados.
Aplicações pacíficas
Este composto desempenhou um papel importante no desenvolvimento de explosivos para fins pacíficos.
Seu papel na invenção da dinamite por Alfred Nobel foi muito significativo. Este cientista combinou nitroglicerina, um poderoso explosivo, com um material poroso, a terra das diatomáceas. Mas a detonação desta mistura é difícil com faíscas ou wicks.
O Nobel excedeu essa dificuldade em usar cartuchos de fulminat de Mercury fulminat que eram confiáveis em sua aplicação. Atualmente, essa combinação permite seu uso em mineração, exploração de pedreiras, construção de túneis e engenharia civil para construção de estradas, ferrovias, portos etc.
Pode servir a você: Buteno Foi amplamente utilizado como detonador de explosões na mineração e construção de estradas. Autor: Nyamdorj. Fonte: Pixabay.
Foi amplamente utilizado como detonador de explosões na mineração e construção de estradas. Autor: Nyamdorj. Fonte: Pixabay. O próprio Alfred Nobel enfatizou a importância fundamental de Mercúrio fulminar em desenvolvimentos de engenharia civil que promoveram a dinamite.
Riscos
É um composto muito instável e extremamente explosivo.
 Autor: Clker-Free-Vector-Imagens. Fonte: Pixabay.
Autor: Clker-Free-Vector-Imagens. Fonte: Pixabay. Produz toxicidade aguda. É tóxico se for ingerido, inalado ou se entrar em contato com a pele. Produz facilmente a dermatite de contato. Causa danos aos órgãos internos se a pessoa for exposta repetidamente ou prolongada.
Muito tóxico para a vida aquática e terrestre com perigo contínuo a longo prazo.
Referências
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- OU.S. Biblioteca Nacional de Medicina. (2019). Mercúrio difulmina. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Munroe, c.E. (1912). Nota sobre a produção de mercúrio fulminate. Journal of Industrial & Engineering Chemistry 1912, 4, 2, 152-153. Recuperado de bares.ACS.org.
- Kurzer, f. (2000). Ácido fulmínico na história da química orgânica. J Chem. Educ. 2000, 77, 7, 851. Recuperado de bares.ACS.org.
- Beck, w. e Klapötke, T.M. (2008). Mercúrio Fulmininate: ONC-HG-CNO ou CNO-HG-ENC-A DFT Estudo. Journal of Molecular Structure: Theochem 848 (2008) 94-97. Recuperado de cientedirect.com.
- Wilson, e. (2007). Mercúrio fulmine revisado. Arquivo de notícias químicas e engenharia 2007, 85, 36, 10. Recuperado de bares.ACS.org.
- Brown, m.E. e Swallowe, G.M. (1981). A decomposição térmica dos sais de prata (i) e mercúrio (II) de 5-nitrotetrazol e de mercúrio (ii) fulminato. Thermochimica Acta, 49 (1981) 333-349. Recuperado de cientedirect.com.
- Alderson, h.E. (1910). Para nova vocação dermatose. Dermatite devido a fulminado seco de mercúrio. Cal State J Med 1910 AP; 8 (4): 114. NCBI se recuperou.Nlm.NIH.Gov.
- Fundação Wikimedia (2020). Mercúrio (ii) fulminar. Recuperado de.Wikipedia.org.
- « Estrutura de cloreto de mercúrio (ii), propriedades, obtenção, uso
- Características e contribuições de civilizações agrícolas »

